Dexmedetomidin
Dexmedetomidin (Handelsname: Dexdor; Hersteller: Orion Corporation) ist das wirksame Isomer (Eutomer) von Medetomidin, welches als Beruhigungsmittel eingesetzt wird.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
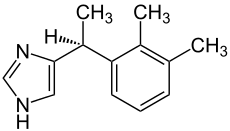 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Dexmedetomidin | |||||||||||||||||||||
| Andere Namen |
(S)-4-[1-(2,3-Dimethylphenyl)ethyl]-3H-imidazol | |||||||||||||||||||||
| Summenformel | C13H16N2 | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code | ||||||||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||||||||
| Wirkmechanismus |
α2-Adrenorezeptor-Agonist | |||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 200,28 g·mol−1 | |||||||||||||||||||||
| Löslichkeit |
löslich in Wasser und DMSO[1] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Wirkmechanismus
Dexmedetomidin aktiviert ähnlich wie Clonidin dosisabhängig α2-Adrenozeptoren und vermindert so die Freisetzung von Noradrenalin. Dies geschieht insbesondere im Locus caeruleus im Hirnstamm, der an der Steuerung von Aufmerksamkeit und Wachheit beteiligt ist. Angeblich führt dieser spezifische Wirkmechanismus zu einem schlafähnlichen Zustand, aus dem die Patienten auf Ansprache sofort wieder erwachen können und in der Lage sind, zu kommunizieren oder Anweisungen zu befolgen. Weiterhin werden auch α2-Adrenozeptoren des sympathischen Nervensystems aktiviert, was zu dessen Hemmung führt (Sympathikolyse).
Vergleich zu anderen Beruhigungsmitteln
Betrachtet man die Anwendung als Beruhigungsmittel auf der Intensivstation, werden folgende Vorteile beworben:
- eine bessere Steuerbarkeit der Sedierungstiefe und -dauer im Vergleich zu Benzodiazepinen
- eine mögliche Langzeitanwendung über mehrere Wochen im Gegensatz zu Propofol
- eine geringere Gewöhnung und Abhängigkeitsentwicklung im Vergleich zu Benzodiazepinen und Opioiden
Ein Nachteil ist der höhere Preis, weswegen es auch nicht so häufig eingesetzt wird. Und wie bei Clonidin ist auf Bradykardien und Blutdruck-Abnahme zu achten.
Wirkung
Neben seiner sedierenden Eigenschaft wirkt Dexmedetomidin vermutlich über eine veränderte Schmerzverarbeitung auch schmerzlindernd (analgetisch), angstlösend und muskelrelaxierend.
Als Nebenwirkung kommt es bei den üblichen geringen Dosen im Rahmen der Hemmung des sympathischen Nervensystems Sympathikolyse zu Herzfrequenzabnahme und Blutdrucksenkung. Bei hohen Konzentrationen, wie sie kurzzeitig beim schnellen intravenösen Spritzen entstehen können, überwiegt die periphere gefäßverengende Wirkung von Dexmedetomidin, so dass es zu einem Blutdruckanstieg kommt.
Anwendung
Dexmedetomidin ist in Deutschland seit 2011 für die Sedierung erwachsener, intensivmedizinisch behandelter Patienten zugelassen.[2] Im Rahmen von Studien existieren Erfahrungen zum Einsatz bei Kindern im Rahmen von Off-Label-Use. Der Ausschuss für Humanarzneimittel (CHMP) der Europäischen Zulassungsbehörde (EMA) hat in seiner Sitzung vom Juni 2018 eine Zulassungserweiterung für Dexmedetomidin empfohlen: Das Sedativum soll zukünftig angewendet werden zur Sedierung nicht-intubierter Patienten vor und/oder während einer diagnostischen oder operativen Maßnahmen, wenn eine Sedierung nötig ist („procedural/awake sedation“).[3] In der Regel kommt die Europäische Kommission einer solchen Empfehlung (positives Votum) nach.
Gegenanzeigen
Kontradindikationen für die Anwendung der Substanz bestehen bei bekannter Unverträglichkeit, unkontrolliert niedrigem Blutdruck, einem AV-Block II – III sowie akuten zerebrovaskulären Ereignissen.[4]
Handelsnamen
- Cepedex, Dexdomitor, Dexdor, Dexmopet, Sedadex, Sileo
Literatur
- H. Ihmsen, T.I. Saari: Dexmedetomidin. In: Der Anaesthesist. 61, 2012, S. 1059–1066, doi:10.1007/s00101-012-2114-1.
Einzelnachweise
- Tocris: Dexmedetomidin, abgerufen am 27. Dezember 2019.
- Fachinformation Dexdor Stand September 2011.
- Summary of opinion (post authorisation), PM EMA vom 28. Juni 2018, abgerufen am 12. Juli 2018.
- Fachinformation Dexdor, herausgegeben von Orion Pharma, Stand Juni 2015.