Debye-Länge
In der Plasmaphysik ist die Abschirmlänge nach Peter Debye Debye-Länge oder Debye-Radius genannt,[1] die charakteristische Länge, auf welcher das elektrische Potential einer lokalen Überschussladung auf das -fache abfällt (: Eulersche Zahl).
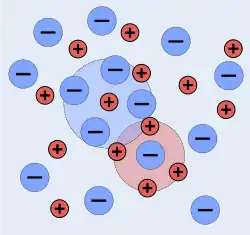
In der näheren Umgebung einer Ladung befinden sich durch die elektrostatische Abstoßung bzw. Anziehung im statistischen Mittel weniger Ladungsträger gleicher Polarität als solche entgegengesetzter Polarität. Dadurch wird die Ladung nach außen hin abgeschirmt (siehe Abbildung). Durch die thermische Bewegung der Teilchen wird die Ordnung gestört und damit die abschirmende Wirkung geschwächt. Die sich ergebende Abschirmlänge ist eine zentrale Größe in der Debye-Hückel-Theorie. Ihr Wert hängt bei gegebenen Bedingungen von der Symmetrie des Problems ab: von Abschirmlänge spricht man bei einer ebenen Ladungsverteilung, von Debye-Radius bei Kugelsymmetrie.
Das Prinzip der Abschirmung einer Ladung durch frei bewegliche Ladungsträger ist anwendbar auf Plasmen, Elektrolyte und Halbleiter.
Debye-Länge in Plasmen
Im Gleichgewicht gilt:
Darin ist
- λD die Debye-Länge
- λDe die Elektronen-Debye-Länge
- λDi die Ionen-Debye-Länge (für einfach geladene Ionen)
- Te, Ti die Temperatur der Elektronen bzw. Ionen
- ne die Teilchendichte der Elektronen
- ε0 die Elektrische Feldkonstante
- kB die Boltzmannkonstante
- e die Elementarladung, also die Ladung eines Elektrons.
In einem Plasma geringer Teilchendichte sind in Gegenwart elektrischer Felder die Elektronen oft viel heißer als die Ionen und deshalb gleichmäßiger verteilt. Dann gilt:
Umgekehrt ist in einem dichten Plasma oder bei schnell veränderlichen Feldern die Beweglichkeit der Ionen zu gering, um ihre Dichte dem Feld anzupassen. Dann kann der Ionen-Term vernachlässigt werden:
- .
Debye-Länge in Elektrolyten
In Elektrolyten hängt die Debye-Länge von der Teilchenzahldichte und Ladungszahl aller beteiligten Ionen ab.[2] Für verdünnte Elektrolyte gilt:[3]
- .
Es ist es üblich die Teilchenzahldichte durch die Ionenstärke I auszudrücken. Damit gilt:
- ,
für Ionenstärke in mol pro Liter. Hier sind die relative Permittivität des Lösungsmittels und die Avogadro-Konstante.
Für wässrige Lösungen () eines 1:1-Elektrolyten wie etwa Kochsalz ergibt sich bei Raumtemperatur ( K) bei einer Konzentration von 0,1 mol/l eine Debye-Länge von 0,96 nm, bei 0,001 mol/l sind es 9,6 nm.
Abweichungen von der Debye-Länge ergeben sich aufgrund der in der Herleitung gemachten Idealisierungen (u. a.: nur elektrostatische Kräfte sind wirksam, keine Korrelationen zwischen den Ionen, Ionen sind Punktladungen), die nur für sehr niedrige Konzentrationen (unter 0,01 mol/l)[4] gut erfüllt sind.[3]
Debye-Länge in Halbleitern
Für einen n-Typ-Halbleiter gilt:
und für einen p-Typ-Halbleiter:
Dabei ist
- die Dielektrizitätskonstante des Halbleiters
- die Temperaturspannung
- bzw. die Gleichgewichts-Ladungsträgerdichte des Halbleiters.
Einzelnachweise
- auch: Debye-Hückel-Länge, Debyescher Abschirmradius, vgl. Debye-Länge. In: Lexikon der Physik. Spektrum Akademischer Verlag, 1998 (spektrum.de).
- McQuarrie and Simon: Physical Chemistry: A Molecular Approach. 25.6. libretexts.org
- Luis M. Varela, Manuel Garcı́a, Vı́ctor Mosquera: Exact mean-field theory of ionic solutions: non-Debye screening. In: Physics Reports. Band 382, Nr. 1–2, 2003, S. 1–111, doi:10.1016/S0370-1573(03)00210-2.
- Hermann Loring: Debye-Hückel-Theorie. In: techniklexikon.net. Abgerufen am 10. Juli 2021.