Diaza-Cope-Umlagerung
Die Diaza-Cope-Umlagerung ist eine Umlagerungsreaktion aus dem Bereich der Organischen Chemie und wie die Claisen-Umlagerung (Oxa-Cope-Umlagerung) eine nach dem US-amerikanischen Chemiker Arthur C. Cope (1909–1966) benannte Heteroatom-Variante der Cope-Umlagerung.[1] Es handelt sich um eine [3.3]-sigmatrope Umlagerung bei chemischen Verbindungen aus der Stroffgruppe der Imine, die ein 2,5-Diazahexa-1,5-dien-Strukturelement aufweisen.[2]

Beispiele
1971 wurde von Michael Dewar vorhergesagt, dass bei einem 3,7-Diazasemibullvalen, einem Semibullvalen, bei dem die Doppelbindungen durch Iminogruppen ersetzt sind, die Aktivierungsenergie der Diaza-Cope-Umlagerung durch die beiden Stickstoffatome energetisch soweit abgesenkt wird, dass der „bishomoaromatische“ Übergangszustand energieärmer als der klassische Grundzustand wird.[3]
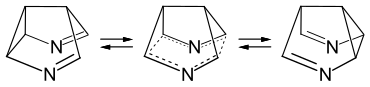
Auch wenn eine experimentelle Bestätigung dieser Voraussage bislang aussteht, wurde in der Folgezeit der Einfluss der Heteroatome auf die Aktivierungsenergie bei der Diaza-Cope-Umlagerung anhand einfach zugänglicher Modellsubstanzen untersucht.
Erste Hinweise auf die Diaza-Cope-Umlagerung zeigte die Valenzisomerisierung von Verbindungen, bei denen die wandernde σ-Bindung Teil eines kleinen Ringes ist:[2]
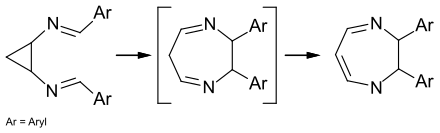
Dabei kann das Primärprodukt der Diaza-Cope-Umlagerung nicht isoliert werden, da es direkt zu einem mit der Imin-Gruppe konjugierten Enamin weiterreagiert.
Das erste Beispiel bei der die Diaza-Cope-Umlagerung nicht durch die Spannung kleiner Ringe erleichtert wird, wurde 1973 publiziert:[4]
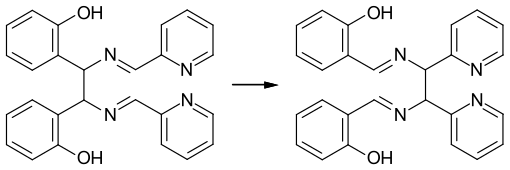
Bereits unter milden Bedingungen erfolgt die Bindungsverschiebung bei tetraarylsubstituierten 2,5-Diazahexa-1,5-dienen mit einer hohen Ausbeute.
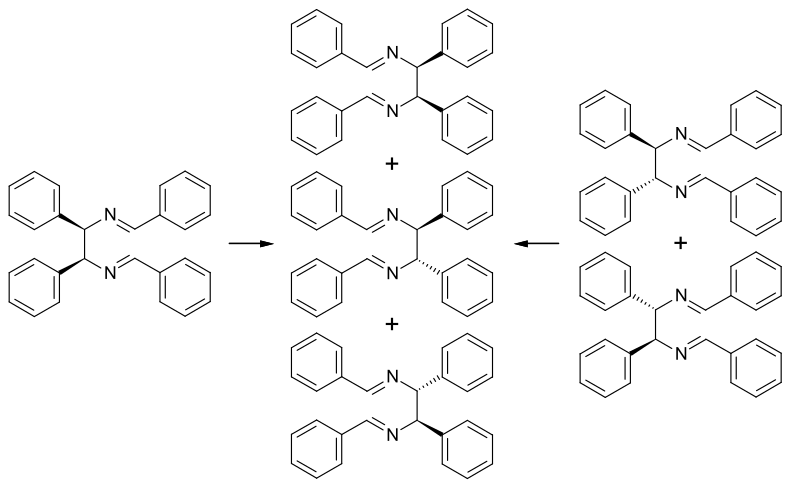
Sind die vier Arylsubstituenten identisch, so handelt es sich um eine entartete Diaza-Cope-Umlagerung. Untersuchungen mit Deuterium-markierten Ausgangsverbindungen zeigen, dass die Diastereomeren von N,N′-Dibenzyliden-1,2-diphenylethylendiamin dasselbe Gleichgewichtsgemisch aus der meso-Verbindung und den d,l-Enantiomeren ergibt, unabhängig von welchem reinen Diastereomer man ausgeht.[5]
Einzelnachweise
- Zerong Wang: Comprehensive Organic Name Reactions and Reagents. John Wiley & Sons, 2009, ISBN 978-0-470-63885-9, Cope Rearrangement, S. 702, doi:10.1002/9780470638859.conrr154.
- Fritz Vögtle, Ernst Goldschmitt: Die Diaza-Cope-Umlagerung. In: Chemische Berichte. Band 109, Nr. 1, 1976, S. 1–40, doi:10.1002/cber.19761090101.
- Michael J. S. Dewar, Donald H. Lo: Ground states of .sigma.-bonded molecules. XIV. Application of energy partitioning to the MINDO [modified intermediate neglect of differential overlap] /2 method and a study of the Cope rearrangement. In: Journal of the American Chemical Society. Band 93, Nr. 26, 1971, S. 7201–7207, doi:10.1021/ja00755a014.
- Fritz Vögtle, Ernst Goldschmitt: [3.3]-Sigmatrope Reaktionen im N,N′-Dimethylen-äthylendiamin-System. In: Angewandte Chemie. Band 85, Nr. 18, 1973, S. 824–826, doi:10.1002/ange.19730851813.
- Fritz Vögtle, Ernst Goldschmitt: Dynamische Stereochemie der entarteten Diaza-Cope-Umlagerung. In: Angewandte Chemie. Band 86, Nr. 14, 1974, S. 520–521, doi:10.1002/ange.19740861408.