Colestilan
Colestilan ist ein Arzneistoff aus der Gruppe der Phosphatbinder, der bei Dialysepatienten zur Senkung zu hoher Phosphatspiegel im Blut (Hyperphosphatämie) eingesetzt wird, dem größten Risikofaktor für Sterblichkeit bei chronischer Nierenerkrankung.[2][3]
| Strukturformel | |||
|---|---|---|---|
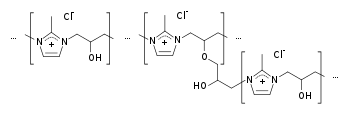 | |||
| Strukturformel ohne Stereochemie | |||
| Allgemeines | |||
| Name | Colestilan | ||
| Andere Namen |
2-(Chlormethyl)oxiran-2-methyl-1H-imidazol-Copolymer (IUPAC) | ||
| CAS-Nummer | 95522-45-5 | ||
| Monomere/Teilstrukturen | Epichlorhydrin, 2-Methylimidazol | ||
| Qualitative Summenformel |
(C4H5ClN2)m(C3H6O)n | ||
| ATC-Code |
V03AE06 | ||
| Arzneistoffangaben | |||
| Wirkstoffklasse | |||
| Wirkmechanismus |
Phosphatbindung im Magen-Darm-Trakt, damit die Gesamtverbindung ausgeschieden werden kann | ||
| Sicherheitshinweise | |||
| |||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||
Colestilan ist ein nicht-resorbierbares Polymer, das Phosphat- und andere Anionen aus der Nahrung im Magen-Darm-Trakt bindet. Im Gegensatz zu den meisten anderen Phosphatbindern enthält es weder Aluminium noch Kalzium, deren langfristige Gabe mit erheblichen Gesundheitsrisiken wie Enzephalopathie oder Atherosklerose verbunden sein kann.[4][5][6]
Pharmakologie
Colestilan ist ein polymerbasiertes Anionen-Austauscherharz, das vom Körper nicht resorbiert werden kann. Aufgrund seiner positiven Ladung bindet es im Magen-Darm-Trakt die aus Nahrung freigesetzten Phosphat-Anionen und wird dann ausgeschieden. Colestilan ist dabei in der Lage, Phosphat in einem weiten pH-Bereich zwischen 3 und 11 zu binden.[6] Darüber hinaus werden auch andere Anionen wie z. B. Gallensäuren an Colestilan gebunden.
Darreichungsform
Colestilan ist in einer Dosierung von einem Gramm als Filmtablette sowie als Granulat in Sachets mit 2 bzw. 3 Gramm Inhalt erhältlich.[2]
Anwendungsgebiete
Colestilan ist in der EU seit April 2013 zur Behandlung von Hyperphosphatämie bei erwachsenen Patienten mit chronischer Nierenerkrankung (CKD Stadium 5D) zugelassen, die eine Hämo- oder Peritonealdialyse erhalten.[2] In Japan ist Colestilan seit 1999 zur Behandlung der Hypercholesterolämie zugelassen.
Wirksamkeit
Die phosphatbindende Wirksamkeit und Sicherheit von Colestilan wurde in 21 klinischen Studien der Phase I-III getestet, darunter Studien mit über 1400 Patienten mit fortgeschrittener Niereninsuffizienz und Hyperphosphatämie. Dabei zeigte sich, dass der Wirkstoff den Serum-Phosphatspiegel und das Kalzium-Phosphat-Ionenprodukt signifikant reduzieren kann.[7][8][9][10][11][12][13][14]
In den Studien zeigten sich darüber hinaus zusätzliche Effekte auf andere Stoffwechselparameter. So senkte Colestilan ab einer Dosierung von 6 g pro Tag den LDL-Cholesterin-Spiegel signifikant, ohne dabei das HDL-Cholesterin zu beeinflussen. Auch die Harnsäurewerte verringerten sich gegenüber einem Placebo.[11] Colestilan hat zudem offenbar einen günstigen Einfluss auf zu hohe HbA1c-Werte: Während es bei Patienten mit einem HbA1c über 7,0 % zu einer Reduktion um bis 0,9 % führte, bewirkte es bei Nicht-Diabetikern mit einem normalen Wert unter 6,0 % keine Senkung.[8]
Die Kassenärztlichen Bundesvereinigung sieht keinen belegten Zusatznutzen bei der Behandlung der Hyperphosphatämie bei Erwachsenen mit chronischer Nierenerkrankung gegenüber Sevelamer oder Lanthancarbonat.[15] Der Gemeinsame Bundesausschuss hat in der gesetzlich vorgeschriebenen Nutzenbewertung nach Marktzutritt in Deutschland festgestellt, dass ein Zusatznutzen nicht belegt sei.[16]
Nebenwirkungen
Die Nebenwirkungen von Colestilan sind dosisabhängig und meist mild bis moderat ausgeprägt. Häufigste Nebenwirkungen, die bei bis zu 10 % aller Patienten auftreten sind Übelkeit, Erbrechen, Verstopfung, Durchfall, Bauchschmerzen und Verdauungsstörungen.[2]
Frühe Nutzenbewertung
In Deutschland müssen seit 2011 neu zugelassene Medikamente mit neuen Wirkstoffen gemäß § 35a SGB V einer „frühen Nutzenbewertung“ durch den Gemeinsamen Bundesausschuss (G-BA) unterzogen werden, wenn der pharmazeutische Hersteller einen höheren Verkaufspreis als nur den Festbetrag erzielen möchte. Nur wenn ein Zusatznutzen besteht, kann der Arzneimittelhersteller mit dem Spitzenverband der gesetzlichen Krankenkassen einen Preis aushandeln. Die Dossierbewertungen, auf deren Basis der G-BA seine Beschlüsse fasst, erstellt das Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG).
In der 2013 erfolgten frühen Nutzenbewertung wurde Colestilan zur Behandlung der Hyperphosphatämie bei Erwachsenen mit chronischer Nierenerkrankung im Stadium 5, die sich einer Hämodialyse oder Peritonealdialyse unterziehen, verglichen mit kalziumhaltigen Phosphatbindern oder Sevelamer oder Lanthankarbonat.[17] Gemäß G-BA-Beschluss ist ein Zusatznutzen gegenüber dieser zweckmäßigen Vergleichstherapie nicht belegt.[18]
Handelsnamen
Colestilan wird von Mitsubishi Tanabe Pharma hergestellt.
Monopräparate
BindRen (D, A, CH), Cholebine (JP)
Einzelnachweise
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- Fachinformation BindRen®, Mitsubishi Pharma Deutschland GmbH, Juli 2014.
- GA Block et al.: Effects of sevelamer and calcium on coronary artery calcification in patients new to hemodialysis. In: Kidney Int., 2005; 68, S. 1815–1824.
- D.W. Mudge et al.: Do aluminium-based phosphate binders continue to have a role in contemporary nephrology practice? In: BMC Nephrol., 2011, 12, S. 20.
- D.A. Bushinsky: Contribution of intestine, bone, kidney, and dialysis to ex-tracellular fluid calcium content. In: Clin J Am Soc Nephrol., 2010, 5(Suppl 1), S. 12.
- RS Shantouf et al.: Total and individual coronary artery calcium scores as in-dependent predictors of mortality in hemodialysis patients. In: Am J Nephrol., 2010, 31, S. 419–425.
- F Locatelli et al.: Effect of MCI-196 on serum phosphate and cholesterol levels in haemodialysis patients with hyperphosphataemia: a double-blind, randomized, placebo-controlled study. In: Nephrol Dial Transplant., 2010; 25, S. 574–581.
- JE Hertel et al. In: J Am Soc Nephrol., 2010, 21 (Abstracts Issue), Abstract F-PO1862.
- N Dimkovic: In: Nephrol Dial Transplant., 2012, 27 (Suppl 2), Abstract SAP575.
- F Locatelli et al. In: J Am Soc Nephrol., 2011, 22 (Abstracts Issue), Abstract FR-OR185.
- C Wanner et al. In: J Am Soc Nephrol., 2012, 23 (Abstracts Issue), Abstract FR-OR028.
- F Senatore et al. In: Nephrol Dial Transplant., 2012, 27 (Suppl 2), Abstract SAO057.
- F Dellanna et al.: 4. Jahrestagung der Deutschen Gesellschaft für Nephrologie 2012. Poste, Hamburg.
- F Senatore et al.: 41st European Dialysis and Transplant Nurses Association / European Renal Care Association (EDTNA/ERCA) International Conference 2012. Poster, Straßburg.
- Colestilan. KBV; abgerufen am 1. Oktober 2014.
- Beschluß „Arzneimittel-Richtlinie/Anlage XII: Colestilan“ des GBA vom 1. Oktober 2013.
- A13-15 Colestilan – Nutzenbewertung gemäß § 35a SGB V (Dossierbewertung). iqwig.de; abgerufen am 27. März 2020.
- Nutzenbewertungsverfahren zum Wirkstoff Colestilan (Hyperphosphatämie). g-ba.de; abgerufen am 27. März 2020.