Cobalteisenstein
Cobalteisenstein ist ein brauner, ferrimagnetischer Feststoff, der in der Spinellstruktur kristallisiert. Er ist ein Mitglied der Reihe von festen Lösungen Co3-xFexO4 die alle in einer Spinellstruktur kristallisieren.[3]
| Kristallstruktur | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
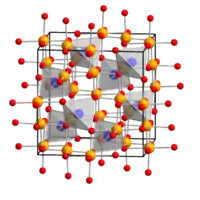 | |||||||||||||
| _ Co2+/Fe3+ _ Fe3+ _ O2− | |||||||||||||
| Allgemeines | |||||||||||||
| Name | Cobalteisenstein | ||||||||||||
| Andere Namen |
Cobaltferrit | ||||||||||||
| Verhältnisformel | CoFe2O4 | ||||||||||||
| Kurzbeschreibung |
grauer Feststoff[1] | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 234,63 g·mol−1 | ||||||||||||
| Aggregatzustand |
fest | ||||||||||||
| Dichte |
5,3 g·cm−3 [2] | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||
Gewinnung und Darstellung
Cobalteisenstein kann durch Reaktion von Cobalt(II)-hydroxid und Eisenhydroxid dargestellt werden.[4]
Es kann auch durch Reaktion von Cobalt(II)-chlorid-hexahydrat mit Ammoniumeisen(III)-sulfat oder durch Reaktion von Eisen(III)-chlorid und Cobalt(II)-chlorid mit Natriumhydroxid gewonnen werden.[5][6]
Physikalische Eigenschaften
Cobalteisenstein liegt als inverser Spinell vor: Die Sauerstoffanionen bilden eine kubisch dichteste Kugelpackung (ccp). Ein Achtel der Tetraederlücken werden von Eisen(III)-Kationen, je ein Viertel der Oktaederlücken von weiteren Eisen(III)-Kationen und Cobalt(II)-Kationen, besetzt. Die Struktur besitzt die Raumgruppe Fd3m (Raumgruppen-Nr. 227). Aufgrund seiner magnetischen Eigenschaften als nichtleitender Permanentmagnet wurde die Verbindung in den 1930er Jahren in Japan intensiv untersucht, später aber durch das billigere Bariumferrit ersetzt.[3] Es ist auch eine Tieftemperaturmodifikation bekannt.[7]
Verwendung
Die Verbindung ist ferrimagnetisch und wird durch seine magnetischen Eigenschaften in der Nanotechnologie als Material für hochkapazitive Magnetspeicher verwendet.[8]
Sie wird auch als Katalysator für die Oxidation von Alkenen eingesetzt.[9]
Einzelnachweise
- Datenblatt Cobalteisenstein bei AlfaAesar, abgerufen am 23. März 2011 (PDF) (JavaScript erforderlich).
- Nanostructured & Amorphous Materials, Inc. Cobalt Iron Oxides, (CoFe2O4, 98 %, 35–55 nm)
- Terence E. Warner: Synthesis, Properties and Mineralogy of Important Inorganic Materials. John Wiley & Sons, 2012, ISBN 978-0-470-97602-9, S. 109 (eingeschränkte Vorschau in der Google-Buchsuche).
- D. Fiorani, Gordon Davies, J. H. Driver, Pierre Steinmetz, Maria Helena Nazaré, Mauro Magini: Synthesis and Properties of Mechanically Alloyed and Nanocrystalline ... 1997, ISBN 0-87849-733-1, S. 110 (eingeschränkte Vorschau in der Google-Buchsuche).
- Philipp Kurz, Norbert Stock: Synthetische Anorganische Chemie Grundkurs. Walter de Gruyter, 2013, ISBN 978-3-11-025875-2, S. 42 (eingeschränkte Vorschau in der Google-Buchsuche).
- K. Maaz, Arif Mumtaz, S.K. Hasanain, Abdullah Ceylan: Synthesis and magnetic properties of cobalt ferrite (CoFe2O4) nanoparticles prepared by wet chemical route. In: Journal of Magnetism and Magnetic Materials. 308, 2007, S. 289, doi:10.1016/j.jmmm.2006.06.003.
- H. P. ROOKSBY, B. T. M. WILLIS: Crystal Structure and Magnetic Properties of Cobalt Ferrite at Low Temperatures. In: Nature. 172, 1953, S. 1054, doi:10.1038/1721054c0.
- Fabrication of Superparamagnetic and Ferromagnetic Nanoparticles. ProQuest, 2008, S. 21 (eingeschränkte Vorschau in der Google-Buchsuche).
- M. Kooti, M. Afshari: Magnetic cobalt ferrite nanoparticles as an efficient catalyst for oxidation of alkenes. In: Scientia Iranica. 19, 2012, S. 1991, doi:10.1016/j.scient.2012.05.005.
