Clavorubin
Clavorubin ist eine organische Verbindung und gehört zu der Farbstoffgruppe der roten Anthrachinonfarbstoffe. Clavorubin gehört zu der zuerst aufgeklärten Gruppe von Farbstoffen im Mutterkorn. Diese zeichnen sich durch ihre erhöhte Acidität und intensive Färbung aus.[3][5]
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
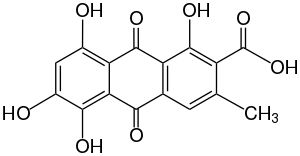 | |||||||||||||
| Allgemeines | |||||||||||||
| Name | Clavorubin | ||||||||||||
| Andere Namen |
| ||||||||||||
| Summenformel | C16H10O8 | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 330,25 g·mol−1[1] | ||||||||||||
| Aggregatzustand |
fest (als Methylester)[2] | ||||||||||||
| Schmelzpunkt |
259 °C (als Methylester)[2] | ||||||||||||
| pKS-Wert |
4,2[3] | ||||||||||||
| Löslichkeit |
schwerlöslich[3] | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||
Vorkommen

Sowohl Clavorubin als auch Endocrocin konnten in der saprophytischen Kultur von purpurbraunem Mutterkornpilz nachgewiesen werden. Darum wird davon ausgegangen, dass es sich um typische Stoffwechselprodukte des Pilzes handelt. Der Gehalt von Clavorubin in Mutterkorn beträgt 0,02 g·kg−1.[5]
Synthese
Die Erforschung des Zusammenhanges zwischen der Alkaloid- und Farbstoffbildung, sowie die Aufklärung von Strukturen derselben sind vor allem auf Arbeiten von Burchard Franck zurückzuführen. Im Vergleich zu Endocrocin enthält Clavorubin lediglich eine zusätzliche Hydroxidgruppe. Darum kann Clavorubin synthetisch durch die spezifische Oxidation von Endocrocin mit Mangandioxid und Schwefelsäure hergestellt werden.[3] Aufgrund ihrer sehr stabil wirkenden Struktur wurden Anthrachinonfarbstoffe als Endprodukte des Stoffwechsels von Pflanzen angenommen. Zehn Jahre nach seiner Entdeckung fand Franck heraus, dass sie durch oxidative Ringöffnung zu gelben Xanthonstoffen weiter verarbeitet werden.[3]
Siehe auch
Literatur
- Hegnauer, R. (1962): : Chemotaxonomie der Pflanzen: Eine Übersicht über die Verbreitung und die systematische Bedeutung der Pflanzenstoffe, 1. Band: Thallophyten, Bryophyten, Pteridophyten und Gymnospermen, Basel: Birkhäuser Verlag, S. 149–150.
- Roth, K. (2010): Chemische Köstlichkeiten. 1. Auflage, Weinheim: Wiley-VCH, ISBN 978-3-527-32752-2, S. 92.
Einzelnachweise
- Chemsrc: 2960-94-3.
- Franck, B. & Zimmer, I.: Konstitution und Synthese des Clavorubins, Chemische Berichte, 1965, 98(5), 1514–1521, doi: 10.1002/cber.19650980527.
- Franck, B.: Struktur und Biosynthese der Mutterkorn-Farbstoffe, Angewandte Chemie, 1969, 81(8), 269–278 , doi:10.1002/ange.19690810802.
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- Franck, B.: Die Farbstoffe des Mutterkorns, 8. Vortragstagung der Deutschen Gesellschaft für Arzneipflanzenforschung 23. Oktober 1960, Heft 4, 420–429.