Chirale Solvatationsreagenzien
Chirale Solvatationsreagenzien (CSRs) sind Verbindungen, die vor allem in der NMR-Spektroskopie genutzt werden, um Enantiomere zu unterscheiden. Das enantiomerenreine Solvatationsreagenz bildet ein diastereomeres Solvat mit dem Analyten. Diastereomere zeigen, im Gegensatz zu Enantiomeren, unterschiedliche NMR-Resonanzen. CSRs gehören zu den NMR-Shift-Reagenzien.
Historie
-alpha-Phenylethylamine_%2526_2%252C2%252C2-Trifluoro-1-phenylethanol_Enantiomers_V.1.svg.png.webp)
]
Die erste Untersuchung zu chiralen Solvatationsreagenzien wurde 1966 von William H. Pirkle durchgeführt. Er entdeckte, dass eine Mischung aus enantiomerenreinem (S)-1-Phenylethylamin (1) und racemischem 2,2,2-Trifluor-1-phenylethanol im 19F-NMR nicht eine, sondern zwei Resonanzen zeigt. Begründet liegt dies darin, dass 1 mit den Enantiomeren (R)-2 und (S)-2 Solvate bildet, die diastereomer zueinander sind. Das Enantiomerenverhältnis von (R)-2:(S)-2 kann durch Integration der Peaks der diastereomeren Solvate bestimmt werden. Aus diesem Verhältnis kann der ee-Wert für 2 berechnet werden.[1] In der Folge dieser Entdeckung wurden weitere CSRs entwickelt, unter anderem 1977 auch Prikles Alkohol.[2]
Wirkungsweise
Chirale Solvatationsreagenzien bilden im Gegensatz zu den chiralen Derivatisierungsreagenzien keine kovalente Bindung zum Analyten aus. Stattdessen wird ein Solvat gebildet, welches durch Wasserstoff-Brücken, Dipol-Dipol-Wechselwirkungen, π-π-Wechselwirkungen oder Ionenpaar-Interaktionen stabilisiert wird.[3]
Arten von Solvatationsreagenzien
- Solvatationsreagenzien mit niedrigem Molekulargewicht, wie Prikles Alkohol
- Solvatationsreagenzien, die einen Ionen-Paar-Effekt ausnutzen[4]
- Molekulare Pinzetten
- Synthetische Makrocyclen
- Cyclodextrine
- Naturstoffe
Einzelnachweise
- W. H. Pirkle: The Nonequivalence of Physical Properties of Enantiomers in Optically Active Solvents. Differences in Nuclear Magnetic Resonance Spectra. I. In: Journal of the American Chemical Society. Band 88, Nr. 8, 1. April 1966, S. 1837–1837, doi:10.1021/ja00960a060.
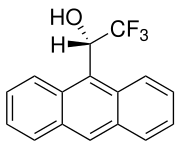
- William H. Pirkle, David L. Sikkenga, Mark S. Pavlin: Nuclear magnetic resonance determination of enantiomeric composition and absolute configuration of .gamma.-lactones using chiral 2,2,2-trifluoro-1-(9-anthryl)ethanol. In: The Journal of Organic Chemistry. Band 42, Nr. 2, Januar 1977, S. 384–387, doi:10.1021/jo00422a061.
- Federica Balzano, Gloria Uccello-Barretta, Federica Aiello: Chiral Analysis by NMR Spectroscopy: Chiral Solvating Agents. In: Chiral Analysis. Elsevier, 2018, ISBN 978-0-444-64027-7, S. 367–427, doi:10.1016/b978-0-444-64027-7.00009-4.
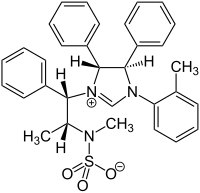
- Sobia Tabassum, Mazhar Amjad Gilani, René Wilhelm: Imidazolinium sulfonate and sulfamate zwitterions as chiral solvating agents for enantiomeric excess calculations. In: Tetrahedron: Asymmetry. Band 22, Nr. 16-17, September 2011, S. 1632–1639, doi:10.1016/j.tetasy.2011.09.018.