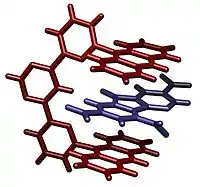
Molekulare Pinzette
Molekulare Pinzetten sind nichtzyklische Wirtmoleküle mit offenen Käfigstrukturen, die in der Lage sind, ein Gastmolekül zu binden. Der Ausdruck molekulare Pinzette wurde erstmals von Howard J. Whitlock verwendet,[3] aber die Art von Wirtmolekülen wurde entwickelt und bekannt gemacht von Steven C. Zimmermann in der Mitte der 1980er bis in die 1990er Jahre[4][5][6] und später von Frank-Gerrit Klärner et al.[7] Die offene Käfigstruktur der molekularen Pinzetten kann Gäste binden, unter Verwendung von nicht-kovalenten Bindungen wie Wasserstoffbrücken, Metallkoordination, Van-der-Waals-Kräften, π-π-Wechselwirkungen und elektrostatischen Effekten. Diese Komplexe sind eine Untergruppe von makrozyklischen molekularen Rezeptoren, und ihre Struktur ist so, dass zwei Arme das Gastmolekül binden können, wobei sie nur an einem Ende verbunden sind, was zu einer bestimmten Flexibilität dieser Rezeptormoleküle führt.
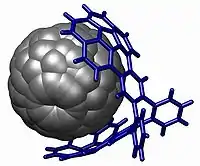
Beispiele
Ein Beispiel für molekulare Pinzetten wurde publiziert von Jean-Marie Lehn u. a. Dieses Wirtmolekül ist in der Lage, aromatische Gäste zu binden.[1] Die molekularen Pinzetten bestehen aus zwei Anthracenarmen, mit einem bestimmten Abstand, der aromatischen Gästen π-π-Wechselwirkungen zwischen beiden erlaubt. Eine andere Klasse von molekularen Pinzetten wurde synthetisiert aus zwei substituierten Porphyrin-Makromolekülen, verknüpft über Amid-Brücken unterschiedlicher Länge. Dieses Beispiel einer molekularen Pinzette zeigt die Flexibilität dieser Substanzklasse, da die Orientierung der Porphrin-Ebenen, aus denen die Pinzette besteht, sich an den gebundenen Gast anpasst.[8]
Noch eine andere Struktur einer molekularen Pinzette wurde publiziert, die speziell Fullerene binden kann, der sogenannte „Buckycatcher“.[2] Dieses Molekül besteht aus zwei konkaven Corannulenen als Pinzette, die die komplette Oberfläche des konvexen Fullerengastes umschließen können. Die Assoziationskonstante Ka zwischen dem Wirt, dem „Buckycatcher“ und dem C60-Fulleren als Gast wurde per NMR berechnet und beträgt 8600 M −1.
Wasserlösliche phosphatsubstituierte Pinzetten binden an den positiv geladenen Seitenketten von Aminosäuren sehr selektiv (Lysin stärker als Arginin).[9] Dabei bevorzugt die molekulare Pinzette, flache Pyridinringe (beispielsweise den Nicotinamidring vom NAD+) zwischen planaren Naphthalinen zu binden.[10] Diese Bindungseigenschaften machen die molekulare Pinzette zum wertvollen Hilfsmittel, um Wechselwirkungen mit Lysinen in Peptiden und auf Proteinoberflächen, ebenso wie bei NAD(P)+ Cofaktoren zu nutzen.[10] Zum Beispiel verhindern beide Verbindungen die Oxidation von Glucose-6-phosphat durch NAD(P)+, die durch Alkoholdehydrogenase katalysiert werden.[11] Zusätzlich verhindert die Pinzette die Bildung von falsch gefalteten Oligomeren und Aggregaten von amyloidogenen Proteinen, einschließlich denen von amyloidem α-Protein[12][13] und β-Synuclein, die als Ursachen für die Alzheimer- und die Parkinson-Krankheit angesehen werden.
Die obigen Beispiele zeigen die potentielle Reaktivität und Spezifität dieser Moleküle. Die Bindungsfläche zwischen den Ebenen der Pinzette kann es ermöglichen, einen passenden Gast zu binden mit einer daraus resultierenden hohen Assoziationskonstante und Stabilität, in Abhängigkeit von der Konfiguration der Pinzette. Das macht die Verbindungsklasse dieser Makromoleküle zu einem echten synthetischen molekularen Rezeptor.
Einzelnachweise
- A. Petitjean, R. G. Khoury, N. Kyritsakas, J. M. Lehn: Dynamic Devices. Shape Switching and Substrate Binding in Ion-Controlled Nanomechanical Molecular Tweezers. In: J. Am. Chem. Soc. Band 126, Nr. 21, 2004, S. 6637–6647, doi:10.1021/ja031915r, PMID 15161291.
- A. Sygula, F. R. Fronczek, R. Sygula, P. W. Rabideau, M. M. Olmstead: A Double Concave Hydrocarbon Buckycatcher. In: J. Am. Chem. Soc. Band 129, Nr. 13, 2007, S. 3842–3843, doi:10.1021/ja070616p, PMID 17348661.
- C.-W. Chen, H. W. Whitlock: Molecular Tweezers - A Simple-Model of Bifunctional Intercalation. In: J. Am. Chem. Soc. 100, 1978, S. 4921.
- S. C. Zimmerman, C. M. VanZyl: Rigid molecular tweezers: synthesis, characterization, and complexation chemistry of a diacridine. In: J. Am. Chem. Soc. 109, 1987, S. 7894.
- S. C. Zimmerman, W. Wu: A rigid molecular tweezers with an active site carboxylic acid: exceptionally efficient receptor for adenine in an organic solvent. In: J. Am. Chem. Soc. 111, 1989, S. 8054.
- S. C. Zimmerman: Rigid molecular tweezers as hosts for the complexation of neutral guests. In: Top. Curr. Chem. 165, 1993, S. 71.
- F.-G. Klärner, B. Kahlert: Molecular Tweezers and Clips as Synthetic Receptors. Molecular Recognition and Dynamics in Receptor-Substrate Complexes. In: Acc. Chem. Res. Band 36, Nr. 12, 2003, S. 919–932, doi:10.1021/ar0200448, PMID 14674783.
- X. Huang, N. Fujioka, G. Pescitelli, F. Koehn, R. T. Williamson, K. Nakanishi, N. Berova: Absolute Configurational Assignments of Secondary Amines by CD-sensitive Dimeric Zinc Porphyrin Host. In: J. Am. Chem. Soc. Band 124, Nr. 17, 2002, S. 10320–10335, doi:10.1021/ja020520p.
- P. Talbiersky, F. Bastkowski, F.-G. Klärner, T. Schrader: Molecular Clip and Tweezer Introduce New Mechanisms of Enzyme Inhibition. In: J. Am. Chem. Soc. Band 130, Nr. 30, 2008, S. 9824–9828, doi:10.1021/ja801441j.
- J. Polkowska, F. Bastkowski, T. Schrader, F.-G. Klärner, J. Zienau, F. Koziol, C. Ochsenfeld: A combined experimental and theoretical study of the pH-dependent binding mode of NAD+ by water-soluble molecular clips. In: J. Phys. Org. Chem. Band 22, Nr. 30, 2009, S. 779–790, doi:10.1002/poc.1519.
- M. Kirsch, P. Talbiersky, J. Polkowska, F. Bastkowski, T. Schaller, H. de Groot, F.-G. Klärner, T. Schrader: A Mechanism of Efficient G6PD Inhibition by a Molecular Clip. In: Angew. Chem. Int. Ed. Band 48, 2009, S. 2886–2890, doi:10.1002/anie.200806175.
- S. Sinha, D. H. J. Lopes, Z. Du, E. S. Pang, A. Shanmugam, A. Lomakin, P. Talbiersky, A. Tennstaedt, K. McDaniel, R. Bakshi, P.-Y. Kuo, M. Ehrmann, G. B. Benedek, J. A. Loo, F.-G. Klärner, T. Schrader, C. Wang, G. Bitan: Lysine-Specific Molecular Tweezers Are Broad-Spectrum Inhibitors of Assembly and Toxicity of Amyloid Proteins. In: J. Am. Chem. Soc. Band 133, Nr. 42, 2011, S. 16958–16969, doi:10.1021/ja206279b.
- A. Attar, C. Ripoli, E. Riccardi, P. Maiti, D. D. Li-Puma, T. Liu, J. Hayes, M. R. Jones, K. Lichti-Kaiser, F. Yang, G. D. Gale, C. H. Tseng, M. Tan, C. W. Xie, J. L. Straudinger, F. G. Klärner, T. Schrader, S. A. Frautschy, C. Grassi, G. Bitan: Protection of primary neurons and mouse brain from Alzheimer’s pathology by molecular tweezers. In: Brain. 135, 2012, S. 3735–3748, doi:10.1093/brain/aws289.