Amyloid-Precursor-Protein
Das Amyloid-Precursor-Protein (Amyloid-Vorläuferprotein, APP) ist ein integrales Membranprotein, von dem man annimmt, dass es bei der Bildung von Synapsen eine Rolle spielt, obwohl seine Funktion bis jetzt noch nicht genau bekannt ist.[1]
| Amyloid-Precursor-Protein | ||
|---|---|---|
| Eigenschaften des menschlichen Proteins | ||
| Masse/Länge Primärstruktur | 753 Aminosäuren | |
| Sekundär- bis Quartärstruktur | single pass Membranprotein | |
| Isoformen | 10 | |
| Bezeichner | ||
| Gen-Name | APP | |
| Externe IDs | ||
| Inhibitorklassifikation | ||
| MEROPS | I02.015 | |
| Vorkommen | ||
| Homologie-Familie | Beta-Amyloid | |
| Übergeordnetes Taxon | Wirbeltiere | |
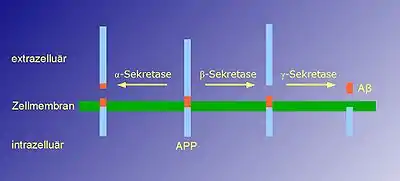
Bei der Spaltung des APP, das eine Größe von 753–770 Aminosäureeinheiten aufweist, durch die Alpha-Sekretasen entstehen kleinere, wasserlösliche Proteine mit 654 bis 670 AS-Bausteinen, sogenannte sAPPs oder APPsα, die neuroprotektive Eigenschaften besitzen.[2]
Bei der Entstehung der Alzheimerkrankheit schneiden zwei Enzyme, die Beta-Sekretase und die Gamma-Sekretase, ein 39 bis 42 Aminosäuren langes, neurotoxisches Bruchstück aus dem Amyloid-Precursor-Protein, welches β-Amyloid genannt wird. Dieses Bruchstück ist ein Hauptbestandteil der Plaques in den Gehirnen von Alzheimer-Patienten.[3]
Beim Menschen liegt das Gen für APP auf dem Chromosom 21. Dies ist der Grund dafür, dass Menschen mit Trisomie 21 (Down-Syndrom) oft in sehr jungen Jahren an Alzheimer erkranken. Alle Tiere haben Homologe.
Mutationen im APP-Gen können familiären (genetisch bedingten) Alzheimer auslösen[4] oder, wie im Fall der Mutation A673T,[5] den Ausbruch der Krankheit verhindern.
Einzelnachweise
- C. Priller, T. Bauer, G. Mitteregger, B. Krebs, H. A. Kretzschmar, J. Herms: Synapse formation and function is modulated by the amyloid precursor protein. In: J Neurosci. 26(27), 2006, S. 7212–7221. PMID 16822978
- Detlev Ganten, Aloys Greither: Molekularmedizinische Grundlagen von altersspezifischen Erkrankungen. Springer-Verlag, 2004, ISBN 3-540-00858-6.
- T. Matsui, M. Ingelsson, H. Fukumoto, K. Ramasamy, H. Kowa, M. P. Frosch, M. C. Irizarry, B. T. Hyman: Expression of APP pathway mRNAs and proteins in Alzheimer's disease. In: Brain Res Epub. 2007. PMID 17586478
- H. Zheng, E. H. Koo: The amyloid precursor protein: beyond amyloid. In: Mol Neurodegener. 3;1, 2006, S. 5. PMID 16930452
- Thorlakur Jonsson, Jasvinder K. Atwal, Stacy Steinberg, Jon Snaedal, Palmi V. Jonsson, Sigurbjorn Bjornsson, Hreinn Stefansson, Patrick Sulem, Daniel Gudbjartsson, Janice Maloney, Kwame Hoyte, Amy Gustafson, Yichin Liu, Yanmei Lu, Tushar Bhangale, Robert R. Graham, Johanna Huttenlocher, Gyda Bjornsdottir, Ole A. Andreassen, Erik G. Jönsson, Aarno Palotie, Timothy W. Behrens, Olafur T. Magnusson, Augustine Kong, Unnur Thorsteinsdottiret al.: A mutation in APP protects against Alzheimer’s disease and age-related cognitive decline, Nature Bd. 488, S. 96–99 (2. August 2012), doi:10.1038/nature11283; abgerufen am 31. Mai 2016.
Literatur
- P. J. Barrett, Y. Song u. a.: The amyloid precursor protein has a flexible transmembrane domain and binds cholesterol. In: Science. Band 336, Nummer 6085, Juni 2012, S. 1168–1171. doi:10.1126/science.1219988. PMID 22654059.
Weblinks
- The Amyloid β-Protein Peptide (AβPP) Family
- Jennifer McDowall, Interpro: Protein Of The Month: Amyloid-b Precursor Protein. (engl.)