Calciumselenid
Calciumselenid, CaSe, ist das Calciumsalz des Selenwasserstoffs.
| Kristallstruktur | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
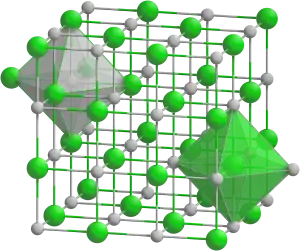 | |||||||||||||||||||
| _ Ca2+ _ Se2− | |||||||||||||||||||
| Kristallsystem | |||||||||||||||||||
| Raumgruppe |
Fm3m (Nr. 225) | ||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Calciumselenid | ||||||||||||||||||
| Verhältnisformel | CaSe | ||||||||||||||||||
| Kurzbeschreibung | |||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 119,038 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte |
3,57 g·cm−3 (20 °C)[1] | ||||||||||||||||||
| Schmelzpunkt |
1408 °C[2] | ||||||||||||||||||
| Löslichkeit | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Gewinnung und Darstellung
Die Reduktion von Calciumselenat mit Wasserstoff lässt neben Wasser auch das Salz entstehen.[2]
Auch die direkte Reaktion beider Elemente ergibt Calciumselenid. Dies wird unter einer inerten Atmosphäre und bei 550 °C gemacht, jedoch liegt die Ausbeute nur bei 50 %.
Eigenschaften
Physikalische Eigenschaften
Analog zu den anderen Erdalkalichalkogeniden ist Calciumselenid kubisch aufgebaut. Dabei besitzt es die Raumgruppe Fm3m (Raumgruppen-Nr. 225).[2]
Chemische Eigenschaften
Die Verbindung zersetzt sich bei Kontakt mit Sauerstoff am Schmelzpunkt zu Calciumoxid und Selendioxid. In Wasser zersetzt sich Calciumselenid bereits bei Raumtemperatur.[2]
Verwendung
Die häufigste Anwendung von Calciumselenid ist als Leuchtstoff. Es leuchtet in blauer Farbe und kann von Infrarotstrahlung angeregt werden.[2]
Toxikologie
Calciumselenid ist bei oraler Einnahme oder Inhalation toxisch. Bei wiederholter oder langer Exposition schädigt es die Organe.[1]
Einzelnachweise
- Datenblatt Calcium Selenide bei AmericanElements, abgerufen am 1. Juli 2019 (PDF).
- Richard C. Ropp: Encyclopedia of the Alkaline Earth Compounds. Newnes, 2012, ISBN 0-444-59553-8, S. 175.


