Bismutchloridoxid
Bismutchloridoxid ist eine chemische Verbindung aus Bismut, Chlor und Sauerstoff, die in der Kosmetikindustrie eingesetzt wird.
| Kristallstruktur | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||
| _ Bi3+ _ Cl− _ O2− | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Bismutchloridoxid | ||||||||||||||||||
| Andere Namen | |||||||||||||||||||
| Verhältnisformel | BiOCl | ||||||||||||||||||
| Kurzbeschreibung |
geruchloser weißer Feststoff[2] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 260,48 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte |
7,72 g·cm−3[2] | ||||||||||||||||||
| Löslichkeit |
nahezu unlöslich in Wasser, leicht löslich in Säuren[3] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Thermodynamische Eigenschaften | |||||||||||||||||||
| ΔHf0 |
−366,9 kJ/mol[5] | ||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Gewinnung und Darstellung
Beim Eintröpfeln einer mit salzsäurehaltigem Wasser bereiteten Lösung von Bismut(III)-chlorid in viel Wasser scheidet sich Bismutchloridoxid (basisches Bismutchlorid) in glänzenden Schüppchen oder als blendend weißes Pulver aus.
Ebenfalls möglich ist die Darstellung durch Reaktion von Bismut(III)-chlorid mit Cadmium(II)-oxid bei 400 °C.[6]
Eigenschaften
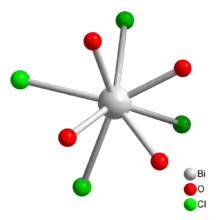
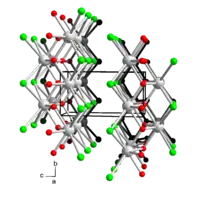
Bismutchloridoxid ist ein farbloses Kristallpulver, das in Wasser nur sehr wenig löslich ist und eine tetragonale Kristallstruktur besitzt. Neben dem Anhydrat existiert auch noch ein Hydrat BiOCl·H2O. Über den Wassergehalt der durch Hydrolyse von Bismut(III)-chlorid erhältlichen Präparate liegen widersprüchliche Literaturangaben vor, sie können aber durch Erhitzen auf > 260 °C zu BiOCl entwässert werden.[6] Bismutchloridoxid (BiClO) kristallisiert tetragonal, Raumgruppe P4/nmm (Raumgruppen-Nr. 129) mit den Gitterparametern a = 3,887 Å und c = 7,354 Å. Die Struktur besteht aus Bi3+-Ionen, die von jeweils vier Chlorid- und Oxidionen koordiniert werden. Das Koordinationspolyeder ist dabei ein quadratisches Antiprisma. Jedes Chlorid- und Oxidion koordiniert weitere drei Bismutionen, so dass eine Schichtstruktur resultiert.[7] Außer BiClO sind auch die Bismutchloridoxide Bi3ClO4[8] und Bi24Cl10O31[9] bekannt.
Verwendung
Bismutchloridoxid wurde früher in der Medizin verwendet und als Schminke benutzt (Wismutweiß, Perlweiß, Schminkpulver, Blanc d'Espagne)[3]. Es dient heute noch als Farbstoff in Lippenstiften, Mascara und ähnlichen kosmetischen Produkten[10] und wird als Material für Perlglanzeffekte (z. B. für Möbel, Elektronikartikel und Haushaltsgegenstände) eingesetzt.[11][12] Auf Grund der Eigenschaft der BiOCl-Pigmente bereits unter Sonnenlicht, teils irreversibel, zu vergrauen wird es i. d. R. aber nicht mehr als unstabilisiertes Pigment für dedizierte Außenanwendungen (z. B. in Automobillackierungen) verwendet[13]. Auch in Kombination mit Prednisolonacetat findet es in Salben oder Suppositorien bei Hämorrhoidalleiden Verwendung.
Literatur
- Gerhard Pfaff: Spezielle Effektpigmente: Grundlagen und Anwendungen. 2. Auflage. Vincentz Network GmbH & Co KG, 2007, ISBN 978-3-86630-895-4; S. 37–39 (eingeschränkte Vorschau in der Google-Buchsuche).
Einzelnachweise
- Eintrag zu CI 7716 in der CosIng-Datenbank der EU-Kommission, abgerufen am 18. September 2021.
- Datenblatt Bismutchloridoxid bei AlfaAesar, abgerufen am 3. Februar 2010 (PDF) (JavaScript erforderlich)..
- Wismutchlorid. In: Meyers Konversations-Lexikon. 4. Auflage. Band 16, Verlag des Bibliographischen Instituts, Leipzig/Wien 1885–1892, S. 696.
- Datenblatt Bismutchloridoxid bei Sigma-Aldrich, abgerufen am 13. März 2011 (PDF).
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-6.
- Georg Brauer (Hrsg.), unter Mitarbeit von Marianne Baudler u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band I, Ferdinand Enke, Stuttgart 1975, ISBN 3-432-02328-6, S. 598.
- K.G. Keramidas, G.P.Voutsas, P.I. Rentzeperis: The crystal structure of BiOCl. In: Zeitschrift für Kristallographie, 205, 1993, S. 35–40, doi:10.1524/zkri.1993.205.Part-1.35.
- U. Eggenweiler, E. Keller, V. Krämer, C.A. Meyer, J. Ketterer: Crystal structure of tribismuth tetraoxide chloride, Bi3ClO4. In: Zeitschrift für Kristallographie – New Crystal Structures, 213, 1998, S. 695.
- U. Eggenweiler, E. Keller, V. Krämer: Redetermination of the crystal structures of the ‘Arppe compound’ Bi24O31Cl10 and the isomorphous Bi24O31Br10. In: Acta Crystallographica, B56, 2000, S. 431–437, doi:10.1107/S0108768100000550.
- pvsoap.com: How to Make Your Own Mineral Makeup (Memento vom 8. Mai 2015 im Internet Archive)
- BBS II Celle: Bunt und Effektpigmente (Memento vom 8. Oktober 2007 im Internet Archive) (MS Word; 171 kB)
- Gerhard Pfaff: Spezielle Effektpigmente: Grundlagen und Anwendungen. Vincentz Network & Co KG, 2007, ISBN 978-3-86630-895-4, S. 37–39.
- Ralf Glausch, Manfred Kieser, Roman Maisch, Gerhard Pfaff, Joachim Weitzel: Perlglanzpigmente. Hrsg.: Ulrich Zorll. Vincentz Verlag, Hannover 1996, ISBN 3-87870-429-1, S. 29 - 31.
