Bismut(III)-bromid
Bismut(III)-bromid ist eine anorganische chemische Verbindung des Bismuts aus der Gruppe der Bromide.
| Kristallstruktur | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
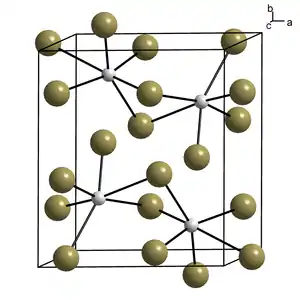 | ||||||||||||||||
| _ Bi3+ _ Br− | ||||||||||||||||
| Kristallsystem | ||||||||||||||||
| Raumgruppe |
P21/n (Nr. 14, Stellung 2) | |||||||||||||||
| Gitterparameter | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Bismut(III)-bromid | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Verhältnisformel | BiBr3 | |||||||||||||||
| Kurzbeschreibung |
orangegelber Feststoff[2] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 448,69 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest[3] | |||||||||||||||
| Dichte |
5,7 g·cm−3 (25 °C)[3] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
461 °C[2] | |||||||||||||||
| Löslichkeit | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Thermodynamische Eigenschaften | ||||||||||||||||
| ΔHf0 | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Gewinnung und Darstellung
Bismut(III)-bromid kann durch Reaktion von Bismut mit Brom bei 250 °C gewonnen werden.[2]
Eigenschaften
Bismut(III)-bromid ist ein hygroskopischer, gelber[4] bis orangegelber, kristalliner Feststoff, der mit Wasser zu Bismutoxidbromid reagiert.[2] Er besitzt eine monokline Kristallstruktur mit der Raumgruppe P21/n (Raumgruppen-Nr. 14, Stellung 2). Im geschmolzenen Zustand ist die Verbindung tiefrot.[4] Im gasförmigen Zustand ist die Struktur pyramidal. Im festen Zustand gibt es zwei Formen mit einer Übergangstemperatur von 158 °C. Die Niedertemperaturform α-Bismut(III)-bromid besitzt eine verzerrte oktaedrische BiBr6-Struktur mit drei kurzen und drei langen Bi-Br-Bindungen. Die Hochtemperaturform ist isotyp zur Struktur von Aluminiumchlorid.[6] Mit Bismut kann die Verbindung zu Bismut(I)-bromid reduziert werden.[7]
Verwendung
Bismut(III)-bromid kann als Katalysator für die Bildung von cyclischen Carbonaten verwendet werden, die wichtige Ausgangsstoffe für Polycarbonate und andere polymere Materialien sind.[3] Er kann auch als Katalysator für weitere organische Synthesen verwendet werden.[8]
Einzelnachweise
- H. von Benda: Zur Polymorphie des Wismuttribromids. In: Zeitschrift für Kristallographie, 1980, 151, S. 271–285 doi:10.1524/zkri.1980.151.3-4.271.
- Georg Brauer (Hrsg.), unter Mitarbeit von Marianne Baudler u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band I, Ferdinand Enke, Stuttgart 1975, ISBN 3-432-02328-6, S. 599.
- Datenblatt Bismuth(III) bromide, anhydrous, powder, 99.999% trace metals basis bei Sigma-Aldrich, abgerufen am 1. Januar 2014 (PDF).
- Jean d’Ans, Ellen Lax, Roger Blachnik: Taschenbuch für Chemiker und Physiker. Springer DE, 1998, ISBN 3-642-58842-5, S. 336 (eingeschränkte Vorschau in der Google-Buchsuche).
- A. F. Holleman, N. Wiberg: Anorganische Chemie. 103. Auflage. 1. Band: Grundlagen und Hauptgruppenelemente. Walter de Gruyter, Berlin / Boston 2016, ISBN 978-3-11-049585-0, S. 952 (Leseprobe: Teil A – Grundlagen der Chemie Der Wasserstoff. Google-Buchsuche).
- N.C. Norman: Chemistry of Arsenic, Antimony and Bismuth. Springer, 1998, ISBN 0-7514-0389-X, S. 95 (eingeschränkte Vorschau in der Google-Buchsuche).
- Erwin Riedel, Christoph Janiak: Anorganische Chemie. Walter de Gruyter, 2011, ISBN 3-11-022567-0, S. 511 (eingeschränkte Vorschau in der Google-Buchsuche).
- Thierry Ollevier: Bismuth-Mediated Organic Reactions. Springer, 2012, ISBN 3-642-27238-X, S. 62 (eingeschränkte Vorschau in der Google-Buchsuche).
