Bergamottin
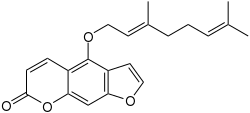
Bergamottin ist eine chemische Verbindung aus der Gruppe der Furocumarine mit Geraniol-Seitenkette. Bergamottin kommt natürlich in der Bergamotte und der Grapefruit vor, in geringeren Mengen auch in anderen Zitrusfrüchten.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Bergamottin | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C21H22O4 | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 338,40 g·mol−1 | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Eigenschaften
Bergamottin ist, wie auch 6',7'-Dihydroxybergamottin, ein Inhibitor von CYP3A4 und mitverantwortlich für den verlangsamten Abbau mancher Arzneimittel nach dem Konsum von Grapefruits.[2][3][4] Durch Bergamottin steigt die orale Bioverfügbarkeit und die Plasmakonzentration dieser Arzneimittel.[5] Die IC50 von Bergamottin bei CYP3A4 liegt unter 10 μM. Die IC50 für Bergamottin bei CYP1B1 liegt bei 13,86 μM.
Bergamottin kann durch Extraktion mit Ethylacetat aus dem Saft der Grapefruit und anschließender Kieselgel-Chromatographie und HPLC isoliert werden. Der Nachweis von Bergamottin erfolgt über HPLC mit UV-Detektor oder durch Massenspektrometrie.[7]
Biosynthese
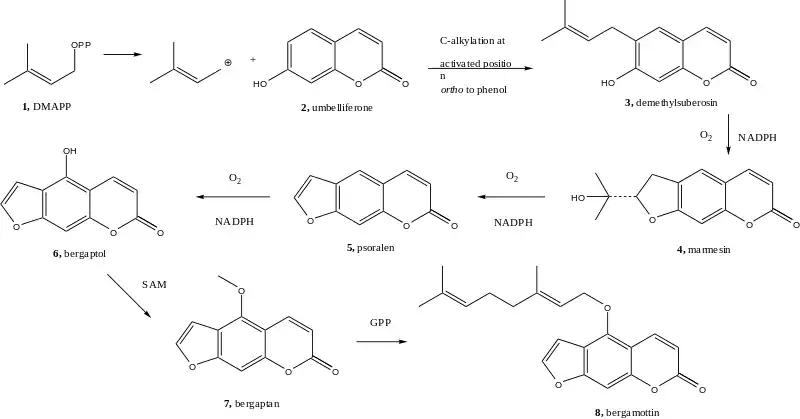
Bergamottin wird über den Shikimat-Weg gebildet.[8] Das Demethylsuberosin (3) wird durch Alkylierung aus Umbelliferon (2) gebildet.[9] Die Alkylierung beginnt mit Dimethylallylpyrophosphat. Ein Ringschluss erzeugt Marmesin (4) unter Verbrauch von NADPH und Sauerstoff durch eine Cytochrom-P450-Monooxygenase.[10] Anschließend wird diese Reaktion zweimal wiederholt, einerseits zur Entfernung der Hydroxyisopropylgruppe von Marmesin (4), wodurch Psoralen (5) gebildet wird, andererseits zur Anfügung einer Hydroxygruppe, wodurch Bergaptol (6) entsteht.[11] Bergaptol wird anschließend mit S-Adenosylmethionin (SAM) methyliert, wodurch Bergapten (7) entsteht. Durch Reaktion mit Geranylpyrophosphat entsteht Bergamottin (8).
Einzelnachweise
- Datenblatt Bergamottin, analytical standard bei Sigma-Aldrich, abgerufen am 10. Juni 2018 (PDF).
- D. G. Bailey, J. Malcolm, O. Arnold, J. D. Spence: Grapefruit juice-drug interactions. In: British journal of clinical pharmacology. Band 46, Nummer 2, August 1998, S. 101–110, PMID 9723817, PMC 1873672 (freier Volltext).
- S. Zhou, S. Yung Chan, B. Cher Goh, E. Chan, W. Duan, M. Huang, H. L. McLeod: Mechanism-based inhibition of cytochrome P450 3A4 by therapeutic drugs. In: Clinical Pharmacokinetics. Band 44, Nummer 3, 2005, S. 279–304, PMID 15762770.
- M. F. Paine, W. W. Widmer, H. L. Hart, S. N. Pusek, K. L. Beavers, A. B. Criss, S. S. Brown, B. F. Thomas, P. B. Watkins: A furanocoumarin-free grapefruit juice establishes furanocoumarins as the mediators of the grapefruit juice-felodipine interaction. In: The American journal of clinical nutrition. Band 83, Nummer 5, Mai 2006, S. 1097–1105, doi:10.1093/ajcn/83.5.1097, PMID 16685052.
- Y. Yamaguchi: Synthesis of Furanocoumarin, Benzofuran and Coumarin Derivatives Possessing an Inhibitory Effect on Human CYP, and Elucidation of the Inhibitory Mechanism. In: Yakugaku Zasshi. Band 137, Nummer 10, 2017, S. 1209–1214, doi:10.1248/yakushi.17-00135, PMID 28966261.
- W. L. Hung, J. H. Suh, Y. Wang: Chemistry and health effects of furanocoumarins in grapefruit. In: Journal of food and drug analysis. Band 25, Nummer 1, Januar 2017, S. 71–83, doi:10.1016/j.jfda.2016.11.008, PMID 28911545.
- P. Dewick: Medicinal Natural Products:A Biosynthetic Approach, 2. Ausgabe, Wiley&Sons, West Sussex, England, 2001. ISBN 978-0470741672. S. 145.
- Emile Bisagni: Synthesis of psoralens and analogues. In: Journal of Photochemistry and Photobiology B: Biology. 14, 1992, S. 23–46, doi:10.1016/1011-1344(92)85081-5.
- A. I. Voznesensky, J. B. Schenkman: The cytochrome P450 2B4-NADPH cytochrome P450 reductase electron transfer complex is not formed by charge-pairing. In: Journal of Biological Chemistry. Band 267, Nummer 21, Juli 1992, S. 14669–14676, PMID 1321814.
- U. M. Kent, H. L. Lin, K. R. Noon, D. L. Harris, P. F. Hollenberg: Metabolism of bergamottin by cytochromes P450 2B6 and 3A5. In: The Journal of pharmacology and experimental therapeutics. Band 318, Nummer 3, September 2006, S. 992–1005, doi:10.1124/jpet.105.099887, PMID 16785317.