Benzilsäure-Umlagerung
Die Benzilsäure-Umlagerung ist eine Umlagerungsreaktion von 1,2-Diketonen zu α-Hydroxycarbonsäuren in Gegenwart starker Basen wie Kaliumhydroxid. Sie ist eng verwandt mit der Cannizzaro-Reaktion und der Benzidin-Umlagerung und wurde zuerst 1838 von Justus Liebig (1803–1873) beschrieben.[1]

Reaktion
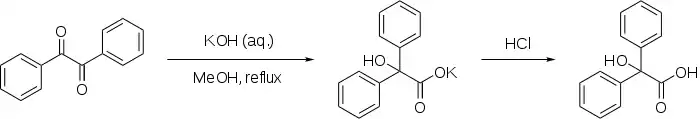
Die Benzilsäure als Namensgeber der Reaktion entsteht durch eine Benzilsäure-Umlagerung aus Benzil (Dibenzoyl).
Diese Diketon-Reaktion ähnelt anderen Umlagerungen: das entsprechende Ketoaldehyd (eine Alkyl- oder Arylgruppe wird durch Wasserstoff ersetzt) lagert sich in einer Cannizzaro-Reaktion um, das 1,2-Diol reagiert entsprechend der Pinakol-Umlagerung.
Reaktionsmechanismus
Die folgende Reaktion ist typisch für 1,2-Umlagerungen. Normalerweise sind an dieser Umlagerung Carbokationen beteiligt, hier aber kommen Carbanionen zu Reaktion. Dieser schon lange bekannte Reaktionsmechanismus wurde durch in-silico-Untersuchungen bestätigt[2] und wird im Folgenden ausgeführt. Ein Hydroxidanion greift eine der Ketogruppen von 1 in einer nucleophilen Addition an und bildet ein Hydroxidanion 2. Im nächsten Schritt erfolgt eine Rotation um die zentrale C-C-Achse, um das Konformere 3 zu erhalten. Die Reste R stehen cis-ständig zueinander. Dies ist nötig, damit der wandernde Rest in einer konzertierten Reaktion die zweite Carbonylgruppe angreifen kann und die entstehende Hydroxygruppe zur ersten Carbonylgruppe revertieren kann. Dieser Schritt ähnelt einer nucleophilen Acyl-Substitution.
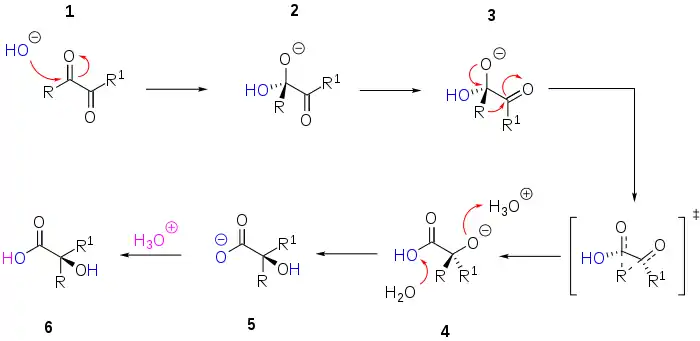
Die Carbonsäure in Zwischenschritt 4 ist weniger basisch als das Hydroxidanion. Deswegen wandert das Proton zur Zwischenstufe 5, diese wiederum kann durch Säure protoniert werden und es bildet sich das Endprodukt α-Hydroxycarbonsäure 6.
Bei cyclischen 1,2-Diketonen kommt es zur Ringspannung.
Die Benzilsäure als Namensgeber der Reaktion entsteht durch eine Benzilsäure-Umlagerung aus Benzil (Dibenzoyl).
Varianten
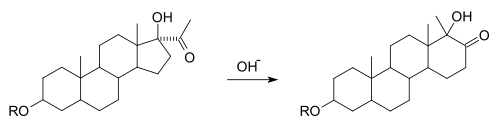
Eine Variante der Umlagerung tritt bei der Synthese verschiedener Steroide auf. In der D-Homo-Umlagerung von Steroiden wird ein Cyclopentanring („D-Ring“) unter Baseneinwirkung zum Cyclohexanring erweitert, also in das nächsthöhere Homologe überführt.[3][4]
Literatur
- Donald A. Ballard and William M. Dehn: Benzilic acid In: Organic Syntheses. 1, 1921, S. 29, doi:10.15227/orgsyn.001.0029; Coll. Vol. 1, 1941, S. 89 (PDF).
Weblinks
- Laboranweisung I (Memento vom 13. Juni 2010 im Internet Archive) (PDF-Datei; 472 kB)
- Laboranweisung II
Einzelnachweise
- Liebig, J.: Ueber Laurent's Theorie der organischen Verbindungen. In: Annalen der Chemie. 25, 1838, S. 1–31. doi:10.1002/jlac.18380250102.
- Shinichi Yamabe, Noriko Tsuchida, and Shoko Yamazaki: A FMO-Controlled Reaction Path in the Benzil-Benzilic Acid Rearrangement. In: J. Org. Chem.. 71, Nr. 5, 2006, S. 1777–1783. doi:10.1021/jo051862r.
- L. Ruzicka, H. F. Meldahl: Über Steroide und Sexualhormone. 48. Mitteilung. Die Überführung von 17-Äthinyl-androsten-Derivaten in Pregnenon-Derivate. Herstellung des 17-Oxy-progesterons Helvetica Chimica Acta 21 (1938) 1760–1770, doi:10.1002/hlca.193802101214.
- L. Ruzicka, H. F. Meldahl: Über Steroide und Sexualhormone. (51. Mitteilung). Die Herstellung von Neo-pregnenolon aus 5-3, 17-Dioxypregnenon-(20) Helvetica Chimica Acta 22 (1939) 421–424, doi:10.1002/hlca.19390220155.