Barton-Decarboxylierung
Die Barton-Decarboxylierung ist eine Namensreaktion der organischen Chemie. Mit ihrer Hilfe können organische Reste z. B. von Carbonsäurechloriden oder Carbonsäuren abgespalten werden. Die Reaktion ist nach dem Chemiker und Nobelpreisträger Derek H. R. Barton benannt.
Übersicht
Die Reaktion ermöglicht die Synthese eines Alkans aus
| einem Carbonsäurechlorid | oder einer Carbonsäure. |
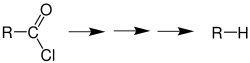 Übersicht der Barton-Decarboxylierung[1] | 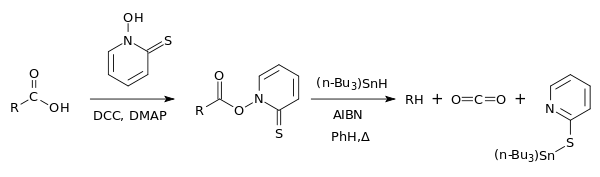 Schema der Barton-Decarboxylierung einer Carbonsäure. |
Mechanismus
Der Mechanismus verläuft in zwei Schritten. Zunächst koppelt man ein Carbonsäurechlorid mit einem Thiopyridin. Das sich ergebende Produkt wird im zweiten Schritt mit einem Radikalstarter – wie etwa Azobis(isobutyronitril) (AIBN) oder einem Peroxid – versetzt.

Im ersten Schritt wird ein Carbonsäurechlorid 1 mit 2-Thioxopyridin-1(2H)-olat 2 versetzt. Das Carbonsäurechlorid wird durch die Umlagerung eines Elektronenpaar des Stickstoff von dem 2-Thioxopyridin-1(2H)-olat 2 angegriffen, wodurch sich das Molekül 3 bildet. Die so neu gebildete Alkoholatgruppe lagert ein Elektronenpaar um. Dadurch wird zum einen das Chlorid aus dem Molekül abgespalten und zum anderen bildet sich eine Carbonylgruppe aus 4. Diese Carbonylgruppe wird nun intramolekular von dem Alkoholat am Pyridinring angegriffen, wodurch sich ein Fünfring im Molekül ausbildet 5. Durch eine weitere Elektronenpaarumlagerungen bildet sich schließlich das gewünschte Zwischenprodukt Molekül 6, welches eine Estergruppe enthält.
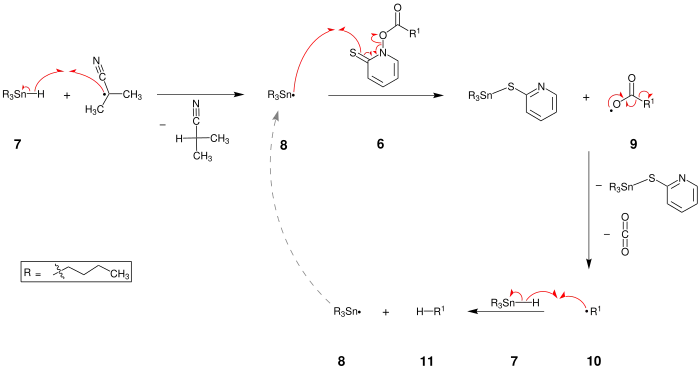
Im zweiten Schritt wird zu Tributylzinnhydrid 7 ein Radikalstarter hinzugegeben. Der Mechanismus wird hier beispielhaft mit einem Isobutyronitril-Radikal beschrieben, welches beim Zerfall von AIBN entsteht. Dadurch bildet sich ein Tributylstannan-Radikal (8), sowie der protonierte Rest des Radikalstarters. Das Radikal 8 wird nun mit dem zuvor gebildeten Pyridinderivat 6 versetzt. Dabei entsteht zum einen 2-[(Tributylstannyl)thio]pyridin und ein Carbonsäureradikal 9. Durch Verschiebung von Elektronen in dem Carbonsäureradikal zerfällt dieses. Dabei entsteht zum einen Kohlenstoffdioxid und ein radikalischer Rest 10. Das verbleibende Radikal 10 reagiert nun wiederum mit einem Tributylzinnhydrid 7 so, dass man den Rest in protonierter Form 11 und wieder ein Tributylstannan-Radikal erhält. Das Produkt 11 ist also ein Molekül, in dem eine Carbonsäurechloridgruppe 1 durch ein Wasserstoffatom ersetzt wurde.
Schwefel-Zinn-Bindungen sind sehr stabil. Treibende Kräfte für die gesamte Reaktion sind zum einen die Ausbildung einer solchen Bindung und zum anderen die Entropieerhöhung durch die Bildung von CO2.
Die Barton-Decarboxylierung ist nicht mit der Barton-Reaktion oder der eng verwandten Barton-McCombie-Desoxygenierung zu verwechseln.
Weblinks
Einzelnachweise
- B. P. Mundy, M. G. Ellerd, F. G. Favaloro: Name Reactions and Reagents in organic Synthesis, 2. Auflage, Wiley-Interscience, Hoboken, NJ 2005, ISBN 978-0-471-22854-7, S. 64.