Baptifolin
Baptifolin ist ein natürlich vorkommendes Alkaloid und gehört zu der Untergruppe der Chinolizidin-Alkaloide.
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
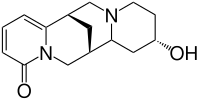 | |||||||||||||
| Allgemeines | |||||||||||||
| Name | Baptifolin | ||||||||||||
| Andere Namen |
| ||||||||||||
| Summenformel | C15H20N2O2 | ||||||||||||
| Kurzbeschreibung |
farbloser Feststoff[1] | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 260,15 g·mol−1 | ||||||||||||
| Aggregatzustand |
fest | ||||||||||||
| Schmelzpunkt |
210 °C[2] | ||||||||||||
| Löslichkeit |
leicht löslich in Wasser und Ethanol[1] | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||
Vorkommen
.JPG.webp)
Baptifolin kommt in vielen Pflanzen als sekundärer Pflanzenstoff vor. Zum Beispiel kommt es neben Spartein, Anagyrin, Cystinin und Lupanin in der Indigolupine (Baptisia australis, oder Blaue Färberhülse) vor. Die Indigolupine kommt überwiegend im zentralen und östlichen Nordamerika vor, Extrakte aus der Wurzel werden arzneilich genutzt. Es lässt sich Baptifolin auch in den Wurzeln der Sophora flavescens – einer Pflanze aus der Familie der Schmetterlingsblütler – nachweisen und findet sich in vielen Kaffeeprodukten und in der Indianerwiege (Caulophyllum thalictroides, Blauer Hahnenfuß). Die Wurzel der Indianerwiege, die außer Baptifolin auch Methylcytisin, Anagyrin und Magnoflorin enthält, ist aus der Volksmedizin bekannt als Mittel zur Wehenanregung und Krampflösung.[4]
Synthese
Im ersten Schritt wird das Cytisin 1, welches totalsynthetisch dargestellt werden kann, mittels Natriumhypochlorit in die N-Chlor-Verbindung 2 umgewandelt. Durch heterocyklische Bindungspaltung wird Chlorid von 2 als Kaliumchlorid eliminiert, zudem wird durch das Hydroxidion des Kaliumhydroxids Wasser abgespaltet. Es entsteht regioselektiv das Imin 3 welches eine polarisierte C=N-Doppelbindung besitzt.

Im folgenden Schritt wird die Grignard-Verbindung aus Allylbromid verwendet um eine neue C-C-Bindung an dem Allylcytisin 4 zu schaffen. Dabei läuft die Grignard-Reaktion zweischrittig ab: erst wird die neue C-C-Bindung gebildet und anschließend wird unter Einwirkung von Wasser MgBrOH abgespalten. Das Allylcytisin 4 wird anschließend mit Formaldehyd versetzt und in Phosphatpufferlösung entsteht nach der Hydrolyse das epi-Baptifolin 5.

Epi-Baptifolin unterscheidet sich u. a. durch einen leicht höheren Schmelzpunkt von 215 °C vom Baptifolin 6 und durch die axiale Stellung der Hydroxygruppe am C13-Atom. Beide Moleküle stehen in einem Gleichgewicht zueinander und in der natürlichen Synthese treten beide parallel in Pflanzen auf.[5]
Literatur
- Tibebe Z. Woldemariam, Joseph M. Betz, Peter J. Houghton: Analysis of aporphine and quinolizidine alkaloids from Caulophyllum thatictroides by densitometry and HPLC, in: Journal of Pharmaceutical and Biomedical Analysis, 1997, 15 (6), S. 839–843; doi:10.1016/S0731-7085(96)01919-X.
- Ferdinand Bohlmann, Dieter Rahtz, Christian Arnd: Die Alkaloide aus Sophora flavescens, in: Chemische Berichte, 1958, 91 (10), S. 2189–2193; doi:10.1002/cber.19580911026.
Einzelnachweise
- J. S. Glasby: Encyclopedia of the Alkaloids (A-H). 1. Auflage. Plenum Press, New York 1975, S. 194; ISBN 0-306-30845-2.
- Baptifoline (FDB011525). In: foodb.ca. Abgerufen am 7. Juli 2017.
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- A.-M. Beer, J. Lukanov, P. Sagorchev: Die Wirkung von Caulophyllum D4 auf die spontane kontraktile Aktivität der glatten Muskulatur, in: Geburtshilfe und Frauenheilkunde, 2000, 60 (9), S. 456–458; doi:10.1055/s-2000-8022.
- F. Bohlmann, E. Winterfeldt, H. Overwien, H. Pagel: Synthese der Alkaloide Angustifolin, Baptifolin und Thermopsin, in: Chemische Berichte, 1961, 95 (4), S. 944–948; doi:10.1002/cber.19620950419.