Bailey-Peptid-Synthese
Die Bailey-Peptid-Synthese ist eine 1949 von J. L. Bailey entwickelte Namensreaktion der Organischen Chemie.[1][2] Sie ist eine Methode zur Peptidsynthese und beschreibt die Synthese eines Peptids ausgehend von der Reaktion von α-Aminosäure-N-carbonsäureanhydriden (NCAs oder Leuchs’sche Anhydride) mit Aminosäuren oder Peptid-Estern.[2][3] Die Besonderheit dieser Namensreaktion ist die kurze Reaktionsdauer und die hohe Ausbeute des zu gewinnenden Peptids.[2]
Übersichtsreaktion
Die Reaktion lässt sich bei niedrigen Temperaturen in organischen Lösungsmitteln durchführen.[2] Bei den Resten R1 bis R2 handelt es sich um organische Reste oder Wasserstoffatome, R3 entspricht dem Restkörper einer Aminosäure oder eines Peptidesters, zugehörig zur dargestellten Aminogruppe:[2]

Reaktionsmechanismus
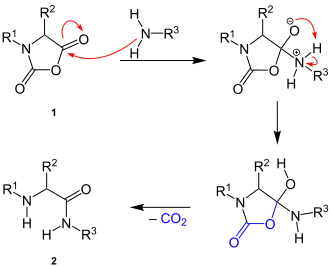
Der Reaktionsmechanismus ist nicht genau bekannt. Es erfolgt ein nukleophiler Angriff der Aminogruppe auf das Kohlenstoffatom der Anhydridgruppe des N-Carbonsäureanhydrids (1). Nach einer intramolekularen Protonenwanderung erfolgt eine 1,4-Protonenverschiebung und die Abspaltung von Kohlenstoffdioxid, wodurch die Peptidbindung im Endprodukt (2) entsteht:[2]
Atomökonomie
Der atomökonomische Vorteil bei der Verwendung von NCAs zur Peptidbildung liegt darin, dass zur Reaktion mit Aminosäuren keine Schutzgruppe an der funktionellen Gruppe vorliegen muss.[4] Beispielsweise basiert die Merrifield-Synthese auf einer Verwendung von Boc- und Bzl-Schutzgruppen, die im Anschluss der Reaktion noch zu entfernen sind.[5] Im Fall der Bailey-Peptid-Synthese liegt nach der Reaktion direkt das freie Peptid vor.[4] Allerdings besteht die Möglichkeit der Entstehung unerwünschter und schwer entfernbarer Nebenprodukte.[4] Eine N-Substitution der NCA (beispielsweise durch einen o-Nitrophenylsulfenylrest) kann den anschließenden Reinigungsvorgang vereinfachen, verschlechtert jedoch im Umkehrschluss die Atomökonomie der Reaktion.[4]
Die Synthese von NCAs kann mittels der Leuchs-Reaktion[6] oder über die Umsetzung von N-(Benzyloxycarbonyl)-aminosäuren mit Oxalylchlorid erfolgen.[7] Wobei im letzteren Fall wiederum im Sinne der Atomökonomie von einem weniger effizienten Verfahren gesprochen werden müsste.
Synthetisierte Peptide
Folgende Peptide wurden bis 1949 mit dieser Methode synthetisiert:[3]
Einzelnachweise
- J. L. Bailey: A new peptide synthesis. In: Nature. Band 164, Nummer 4177, November 1949, S. 889, PMID 15407090.
- Daniel Zerong Wang: Comprehensive Organic Name Reactions and Reagents. Band 1. John Wiley & Sons, Inc., Hoboken New Jersey 2009, ISBN 978-0-471-70450-8, S. 156–159 (englisch).
- J. Leggett Bailey: A new Peptide Synthesis. In: Nature. Band 164, Nr. 4177, 1949, S. 889, doi:10.1038/164889a0.
- Ryoichi Katakai: Peptide Synthesis Using o-Nitrophenylsulfenyl N-Carboxy α-Amino Acid Anhydrides. In: The Journal of Organic Chemistry., Band 40, Nr. 19, 1975, S. 2697–2702, doi:10.1021/jo00907a001.
- Hans-Dieter Jakubke: Peptide. Chemie und Biologie. Spektrum Akademischer Verlag GmbH, Heidelberg Berlin Oxford 1996, ISBN 3-8274-0000-7, S. 178.
- Hans Rytger Kricheldorf: α-Aminoacid-N-Carboxy-Anhydrides and Related Heterocycles. Syntheses, Properties, Peptide Synthesis, Polymerization. Springer Verlag, Berlin Heidelberg, 1987, S. 1–4, doi:10.1007/978-3-642-71586-0, ISBN 978-3-642-71588-4 (Druck), ISBN 978-3-642-71586-0 (Online).
- D. Konopinska, I.Z. Siemion: Synthesis of N-Carboxy-α-amino Acid Anhydrides. In: Angewandte Chemie International Edition. Band 6, Nr. 3, 1967, S. 248, doi:10.1002/anie.196702481.
Literatur
- P. Katsoyannis: The Chemistry of Polypeptides. Springer Science & Business Media, 2012, ISBN 978-1-4613-4571-8, S. 129.