Büchner-Curtius-Schlotterbeck-Reaktion
Die Büchner-Curtius-Schlotterbeck-Reaktion (auch Schlotterbeck-Reaktion) ist eine Namensreaktion der organischen Chemie, die 1885 zuerst von Eduard Buchner und Theodor Curtius beschrieben wurde.[1] Eine nähere Betrachtung erfolgte 1907 durch Fritz Schlotterbeck.[2] Es handelt sich um eine Reaktion zwischen einer Carbonylverbindung (Aldehyd oder Keton) und einem Diazoalkan unter Bildung neuer Aldehyde, Ketone oder Epoxide. Als Erweiterung der Reaktion gilt die Synthese von β-Ketoestern als Produkt der Kondensationsreaktion von Aldehyden mit Diazoestern.[3]
Übersichtsreaktion
Bei der Schlotterbeck-Reaktion reagieren ein Aldehyd oder Keton 1 und ein Diazoalkan 2 zu einem Aldehyd oder Keton 3 und/oder 4 und/oder einem Epoxid 5. Dabei hängt das Verhältnis der Reaktionsprodukte von den verwendeten Reaktanten und den Reaktionsbedingungen ab.[3]
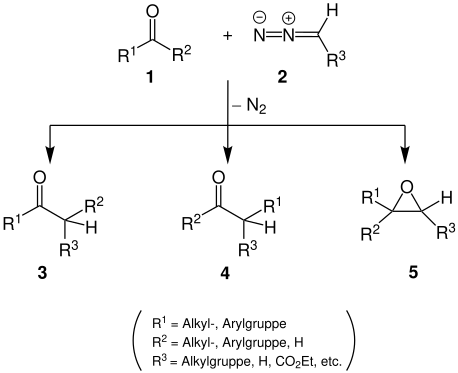
Reaktionsmechanismus
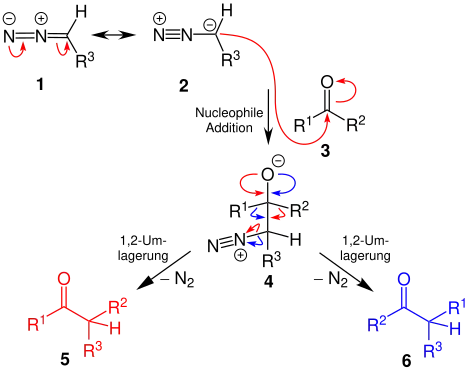
Die Diazoverbindung lässt sich in den Resonanzstrukturen 1 und 2 darstellen. Das freie Elektronenpaar am Kohlenstoffatom, welches neben dem Stickstoffatom in Verbindung 2 vorliegt, greift nucleophil an der Carbonylverbindung 3 an. Es bildet sich ein tetraedrisches Zwischenprodukt 4, welches sich unter Abspaltung von gasförmigem Stickstoff und einer 1,2-Umlagerung zu den Carbonylverbindungen 5 und/oder 6 zersetzt.[3][4]
Der Reaktionsmechanismus zur Bildung des Epoxids 7 verläuft bis zur Bildung des tetraedrischen Zwischenprodukts 4 analog als nucleophile Addition.
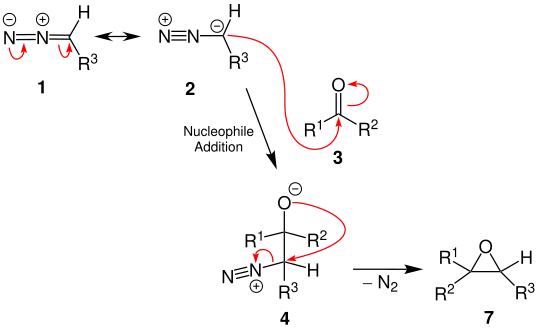
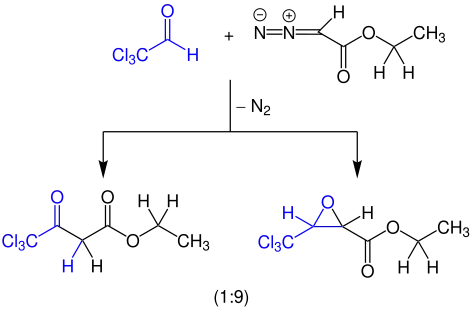
Beispielreaktion
Über die Schlotterbeck-Reaktion kann Ethyl-4,4,4-trichloracetat und Ethyl-3-(trichlormethyl)glycidat in einem Verhältnis von 1:9 und einer Ausbeute von 80,4 % aus Chloral und Ethyldiazoacetat erhalten werden.[5]
Atomökonomie
Bei der Schlotterbeck-Reaktion fällt im Wesentlichen nur Stickstoffgas in stöchiometrischen Mengen als Abfallstoff an, wodurch die Atomeffizienz als verhältnismäßig gut eingestuft werden kann. Bei der Betrachtung ökonomischer Gesichtspunkte ist bei dieser Reaktion jedoch zu beachten, dass diese häufig keine sauberen Produkte liefert, da die Bildung verschiedener Reaktionsprodukte möglich und nur begrenzt beeinflussbar ist.[3]
Modifikation
Eine Erweiterung der Schlotterbeck-Reaktion ermöglicht eine direkte Umsetzung von Aldehyden zu β-Ketoestern. Dies ist beispielsweise bei der Reaktion von Aldehyden mit Ethyldiazoacetat in Gegenwart einer katalytischen Menge von Zinn(II)-chlorid der Fall.[6] Auch die Nierenstein-Reaktion, eine Reaktion von Diazoalkanen und Carbonsäurehalogeniden zur Bildung von α-Halogenmethylketonen, kann als eine Erweiterung der Schlotterbeck-Reaktion angesehen werden.[7]
Einzelnachweise
- E. Buchner, Th. Curtius: Synthese von Ketonsäureäthern aus Aldehyden und Diazoessigäther. In: Berichte der deutschen chemischen Gesellschaft. Band 18, Nr. 2, Juli 1885, S. 2371–2377, doi:10.1002/cber.188501802118.
- Fritz Schlotterbeck: Umwandlung von Aldehyden in Ketone durch Diazomethan. (Erwiderung an Hrn. H. Meyer). In: Berichte der deutschen chemischen Gesellschaft. Band 40, Nr. 2, März 1907, S. 1826–1827, doi:10.1002/cber.19070400285.
- Schlotterbeck Reaction. In: Comprehensive Organic Name Reactions and Reagents. John Wiley & Sons, Inc., Hoboken, NJ, USA 2010, ISBN 978-0-470-63885-9, S. 2491–2494, doi:10.1002/9780470638859.conrr563.
- Büchner-Curtius-Schlotterbeck reaction. In: Name Reactions. Springer Berlin Heidelberg, Berlin, Heidelberg 2006, ISBN 978-3-540-30030-4, S. 94–95, doi:10.1007/3-540-30031-7_46.
- David K. Wald, Madeleine M. Joullié: Trichloroacetoacetates. I. Synthesis and Reactions of Ethyl and β,β,β-Trifluoroethyl Trichloroacetoacetates. In: The Journal of Organic Chemistry. Band 31, Nr. 10, Oktober 1966, S. 3369–3374, doi:10.1021/jo01348a060.
- Christopher R. Holmquist, Eric J. Roskamp: A selective method for the direct conversion of aldehydes into .beta.-keto esters with ethyl diazoacetate catalyzed by tin(II) chloride. In: The Journal of Organic Chemistry. Band 54, Nr. 14, Juli 1989, S. 3258–3260, doi:10.1021/jo00275a006.
- Douglas Arthur Clibbens, Maximilian Nierenstein: CLXV.—The action of diazomethane on some aromatic acyl chlorides. In: J. Chem. Soc., Trans. Band 107, Nr. 0, 1915, S. 1491–1494, doi:10.1039/ct9150701491.