Ataluren
Ataluren ist ein Arzneistoff zur Behandlung von Krankheiten genetischen Ursprungs, die auf nonsense-Mutationen beruhen, das ein Ablesen des Gens über das Stopcodon hinaus vermitteln soll.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
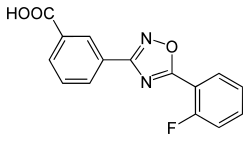 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Ataluren | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C15H9FN2O3 | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code |
M09AX03 | |||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 284,24 g·mol−1 | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Zugelassen ist Ataluren unter dem Namen Translarna zur Behandlung der Muskeldystrophie Duchenne.[2] Die Substanz ist oral wirksam. Ataluren wurde auch als Arzneistoff gegen Mukoviszidose (Cystische Fibrose) ins Auge gefasst.
Wirkungsmechanismus
Im Tierversuch regte Ataluren in den Muskelzellen von Mäusen die Bildung des Proteins Dystrophin an, dessen Fehlen für die Muskelschwäche, wie sie bei der Muskeldystrophie Duchenne auftritt, verantwortlich gemacht wird.[3][4]
Für den potentiellen Einsatz bei cystischer Fibrose (Mukoviszidose) wird als möglicher Wirkungsmechanismus angeführt, dass durch Ataluren die bei dieser Krankheit fehlende Expression des CFTR-Proteins wiederhergestellt und damit der krankhaft eingeschränkte Wasser- und Chloridionentransport aus Epithelzellen wieder normalisiert wird.[5] Damit einher geht die Verflüssigung der bei cystischer Fibrose krankhaft zähflüssigen Körpersekrete. Einen vergleichbaren Wirkungsmechanismus in dieser Indikation weist auch das Antibiotikum Gentamicin auf, gegenüber diesem soll Ataluren aber weniger unerwünschte Wirkungen haben und kann auch oral (anstatt wie Gentamicin inhalativ) verabreicht werden.
Die Plasmahalbwertszeit von Ataluren beträgt 3 bis 6 Stunden.[6]
Entwicklung und Zulassung
Für die Behandlung der Muskeldystrophie Duchenne und der cystischen Fibrose wurde die Substanz seitens der Europäischen Kommission 2005 als Orphan Drug im Gemeinschaftsregister der EU eingetragen.[7][8]
2014 wurde Ataluren als Translarna (Hersteller: PTC Therapeutics, South Plainfield, New Jersey, USA) in der EU zugelassen in der Indikation Muskeldystrophie Duchenne bei gehfähigen Patienten ab einem Alter von 5 Jahren. Im Mai 2018 folgte eine Zulassungserweiterung für Kinder ab 2 Jahren.
Weitere potentielle Anwendungsgebiete stellen die seltenen Krankheiten Muskeldystrophie Becker und Aniridie dar, für die Ataluren ebenfalls jeweils der Orphan-Status zugebilligt wurde.[9][10]
Einzelnachweise
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- Zusammenfassung des EPAR für die Öffentlichkeit, EPAR der EMA, abgerufen am 13. Juni 2018
- EMEA/COMP/122996/2005 Rev.2 (Memento vom 26. Dezember 2009 im Internet Archive) (PDF; 121 kB) Beurteilung des Committee for Orphan Medicinal Products (COMP) der Europäischen Arzneimittelagentur, 3. Juli 2007.
- E. M. Welch, E. R. Barton u. a.: PTC124 targets genetic disorders caused by nonsense mutations. In: Nature. Band 447, Nummer 7140, Mai 2007, S. 87–91, doi:10.1038/nature05756, PMID 17450125.
- EMEA/COMP/123054/2005 Rev.3 (Memento vom 26. Dezember 2009 im Internet Archive) (PDF; 127 kB), Beurteilung des Committee for Orphan Medicinal Products (COMP) der Europäischen Arzneimittelagentur, 3. Juli 2007.
- S. Hirawat, E. M. Welch u. a.: Safety, tolerability, and pharmacokinetics of PTC124, a nonaminoglycoside nonsense mutation suppressor, following single- and multiple-dose administration to healthy male and female adult volunteers. In: Journal of clinical pharmacology. Band 47, Nummer 4, April 2007, S. 430–444, doi:10.1177/0091270006297140, PMID 17389552.
- Eintrag EU/3/05/277 im EU-Gemeinschaftsregister für Orphan Drugs. Abgerufen am 28. Februar 2019.
- Eintrag EU/3/05/278 im EU-Gemeinschaftsregister für Orphan Drugs. Abgerufen am 28. Februar 2019.
- Eintrag EU/3/12/1010 im EU-Gemeinschaftsregister für Orphan Drugs, abgerufen am 28. Februar 2019.
- Eintrag EU/3/15/1561 im EU-Gemeinschaftsregister für Orphan Drugs, abgerufen am 28. Februar 2019.