Hydroxynorketamin
Hydroxynorketamin (HNK) ist ein Metabolit von Ketamin, welches durch Hydroxylierung seines Metaboliten Norketamin gebildet wird.[2] Im Gegensatz zu Ketamin und Norketamin ist Hydroxynorketamin als Anästhetikum und Dissoziativum inaktiv und produziert keine Rauschzustände.[3][4]
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
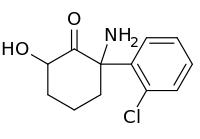 | |||||||||||||
| Strukturformel ohne Stereochemie | |||||||||||||
| Allgemeines | |||||||||||||
| Name | Hydroxynorketamin | ||||||||||||
| Andere Namen |
2-Amino-2-(2-chlorphenyl)-6-hydroxycyclohexanon (IUPAC) | ||||||||||||
| Summenformel | C12H14ClNO2 | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Arzneistoffangaben | |||||||||||||
| Wirkstoffklasse | |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 239,70 g·mol−1 | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||
Stereochemie
Hydroxynorketamin besitzt zwei chirale Zentren, es gibt daher vier Stereoisomere.
| Stereoisomere des Hydroxynorketamins | |||
|---|---|---|---|
-Hydroxynorketamine_Formula_V1.svg.png.webp) (2R,6R)-Stereoisomer |
-Hydroxynorketamine_Formula_V1.svg.png.webp) (2S,6S)-Stereoisomer |
-Hydroxynorketamine_Formula_V1.svg.png.webp) (2R,6S)-Stereoisomer |
-Hydroxynorketamine_Formula_V1.svg.png.webp) (2S,6R)-Stereoisomer |
Pharmakologie
Die pharmakologische Wirkung von Ketamin bei Depressionen wird auf den Metabolit (2R,6R)-Hydroxynorketamin zurückgeführt. Dies wurde erstmals 2016 demonstriert und im Journal Nature veröffentlicht.[5] (2R,6R)-HNK zeigte noch 3 Tage nach Verabreichung an Mäusen antidepressivartige Effekte. Im Gegensatz zu Ketamin wirkt HNK kaum an den NMDA-Rezeptoren (Ki = 21,19 µM für (2S,6S)-HNK und > 100 μM für (2R,6R)-HNK), sondern vermittelt seine Wirkung über AMPA-Rezeptoren.[6][7][5] HNK zeigt keine suchtbildende Wirkung in Mäusen.[5]
Weblinks
- Govi-Verlag Pharmazeutischer Verlag: Ketamin: Metabolit wirkt rasch antidepressiv. In: pharmazeutische-zeitung.de. 6. Mai 2016, abgerufen am 8. Mai 2016.
- Ketamine lifts depression via a byproduct of its metabolism. In: nih.gov. 4. Mai 2016, abgerufen am 7. Mai 2016 (englisch).
Einzelnachweise
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- Ronald D. Miller, Lars I. Eriksson, Lee A Fleisher, Jeanine P. Wiener-Kronish, William L. Young: Anesthesia. Elsevier Health Sciences, 24. Juni 2009, ISBN 1-4377-2061-7, S. 743–.
- Louis Y. Leung, Thomas A. Baillie: Comparative pharmacology in the rat of ketamine and its two principal metabolites, norketamine and (Z)-6-hydroxynorketamine. In: Journal of Medicinal Chemistry. 29, 1986, S. 2396, doi:10.1021/jm00161a043.
- Irving W. Wainer: Are basal D-serine plasma levels a predictive biomarker for the rapid antidepressant effects of ketamineand ketamine metabolites?. In: Psychopharmacology. 231, 2014, S. 4083, doi:10.1007/s00213-014-3736-6.
- Panos Zanos, Ruin Moaddel u. a.: NMDAR inhibition-independent antidepressant actions of ketamine metabolites. In: Nature. 2016, doi:10.1038/nature17998.
- Ruin Moaddel, Galia Abdrakhmanova u. a.: Sub-anesthetic concentrations of (R,S)-ketamine metabolites inhibit acetylcholine-evoked currents in α7 nicotinic acetylcholine receptors. In: European Journal of Pharmacology. 698, 2013, S. 228, doi:10.1016/j.ejphar.2012.11.023.
- Nagendra S Singh, Carlos A Zarate, Ruin Moaddel, Michel Bernier, Irving W Wainer: What is hydroxynorketamine and what can it bring to neurotherapeutics? In: Expert Review of Neurotherapeutics. 14, 2014, S. 1239, doi:10.1586/14737175.2014.971760.