Ammoniumdiuranat
Ammoniumdiuranat (ADU) ist eine chemische Verbindung aus Stickstoff, Wasserstoff, Uran und Sauerstoff. Es entsteht zusammen mit Natriumdiuranat bei der Produktion von Yellowcake. Formal lässt sich ADU durch die Summenformel (NH4)2U2O7 charakterisieren. Tatsächlich werden verschiedene Spezies unterschiedlicher Zusammensetzung gefunden, für die sich die allgemeine Formel [m UO3 · 2n NH3 · 2(m–n) H2O] · p H2O formulieren lässt.[5]
| Kristallstruktur | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
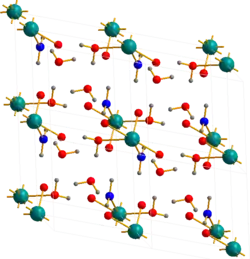 | ||||||||||||||||
| _ H+ _ U6+ _ O2− _ N3− | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Ammoniumdiuranat | |||||||||||||||
| Verhältnisformel | (NH4)2U2O7 | |||||||||||||||
| Kurzbeschreibung |
gelb-rötlicher Feststoff[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 624,13 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Löslichkeit |
nahezu unlöslich in Wasser und Laugen, löslich in Säuren[1] | |||||||||||||||
| Gefahren- und Sicherheitshinweise | ||||||||||||||||

Radioaktiv | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Darstellung
Ammoniumdiuranat wird aus Uranylsulfat-Lösung durch Zusatz von wässriger Ammoniaklösung gefällt:[6]
Diese Reaktion kann in der Analytischen Chemie auch als Nachweis für Uran(VI)-Verbindungen verwendet werden.
Verwendung

Das durch obige Reaktion gewonnene Ammoniumdiuranat (technisch auch Yellowcake genannt[7]) wird verglüht, um daraus Triuranoctoxid zu gewinnen. Diese Reaktion verläuft über mehrere Zwischenstufen; zunächst wird ein Teil des Kristallwassers sowie Ammoniak abgespalten, bevor die UO3-Einheiten dehydratisiert werden und schließlich Sauerstoff abgespalten wird.[5] Formal lautet die Gesamtgleichung:
Das Triuranoctoxid wird im weiteren Prozess der Uranherstellung mit Salpetersäure umgesetzt. Dadurch entsteht Uranylnitrat, aus dem reines Urantrioxid isoliert werden kann. Dieses wird mit Wasserstoff zu Urandioxid reduziert. Bringt man Urandioxid mit Flusssäure und Fluor zur Reaktion, entsteht Uranhexafluorid, aus welchem schließlich durch Reduktion mittels Calcium oder Magnesium reines Uran gewonnen wird.[6]
Einzelnachweise
- SLAC: PHYSICAL CONSTANTS OF INORGANIC COMPOUNDS (PDF; 391 kB).
- Nicht explizit in Verordnung (EG) Nr. 1272/2008 (CLP) gelistet, fällt aber mit der angegebenen Kennzeichnung unter den Gruppeneintrag uranium compounds with the exception of those specified elsewhere in this Annex im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Eintrag zu Uranverbindungen in der GESTIS-Stoffdatenbank des IFA, abgerufen am 1. Februar 2016. (JavaScript erforderlich)
- Die von der Radioaktivität ausgehenden Gefahren gehören nicht zu den einzustufenden Eigenschaften nach der GHS-Kennzeichnung.
- Gmelins Handbuch der anorganischen Chemie – Uran, Ergänzungsband Teil C 3, Verbindungen, 8. Auflage, Berlin, Heidelberg, 1975.
- Nuclear Chemistry - Uranium Production (englisch)
- Harry H. Binder: Lexikon der chemischen Elemente, S. Hirzel Verlag, Stuttgart 1999, ISBN 3-7776-0736-3.
Literatur
- Ingmar Grenthe, Janusz Drożdżynński, Takeo Fujino, Edgar C. Buck, Thomas E. Albrecht-Schmitt, Stephen F. Wolf: Uranium, in: Lester R. Morss, Norman M. Edelstein, Jean Fuger (Hrsg.): The Chemistry of the Actinide and Transactinide Elements, Springer, Dordrecht 2006; ISBN 1-4020-3555-1, S. 253–698 (doi:10.1007/1-4020-3598-5_5).


