Abarelix
Abarelix (Handelsname: Plenaxis®) ist ein Arzneistoff aus der Gruppe der GnRH-Antagonisten, der zur Behandlung des fortgeschrittenen oder metastasierten hormonabhängigen Prostatakarzinoms eingesetzt wird.
| Abarelix | ||
|---|---|---|
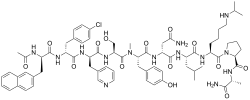 | ||
| Strukturformel | ||
| Masse/Länge Primärstruktur | 10 Aminosäuren, 1416 Da | |
| Bezeichner | ||
| Externe IDs |
| |
| Arzneistoffangaben | ||
| ATC-Code | L02BX01 | |
| DrugBank | DB00106 | |
| Wirkstoffklasse | Zytostatikum | |
Pharmakologische Eigenschaften
Abarelix wird durch Intramuskuläre Injektion appliziert und führt über das Wirkprinzip der kompetitiven Rezeptorenhemmung zu einer schnellen jedoch reversiblen Unterbrechung der Testosteron-Produktion. Im Gegensatz zur Behandlung mit einem LHRH-Analogon kommt es unter Abarelix nicht zu einer Testosteron-Anflutung (Anstieg des Testosteronspiegels), die unter Umständen eine Verschlimmerung des Krankheitsbildes auslösen kann. Eine Kombination mit Antiandrogenen zur Verhinderung des Effektes einer Testosteron-Anflutung ist daher nicht erforderlich.
Klinische Studien haben gezeigt, dass unter einer Abarelix-Behandlung sowohl im Vergleich mit einer LHRH-Analogon-Behandlung (z. B. Leuprorelin, Goserelin, Buserelin), als auch im Vergleich mit einer maximalen Androgenblockade (LHRH-Analogon + Antiandrogen) Testosteron und PSA schneller gesenkt werden. Nach Absetzen einer Behandlung mit Abarelix wird der Wirkstoff ausgewaschen und Testosteron kann vom Organismus neu produziert werden, wonach die Nebenwirkungen eines Testosteronentzugs abklingen. Bei Notwendigkeit kann die Behandlung wieder neu begonnen werden.
Nebenwirkungen
Abarelix kann anaphylaktoide Reaktionen auslösen (in klinischen Studien bei 1,1 % aller behandelten Patienten, allerdings bei 3,7 % der Patienten mit fortgeschrittenem Prostatakrebs). Aus diesem Grund ist es erforderlich, den Patienten mindestens 30 Minuten nach der Injektion zu beobachten. Eine weitere kritische Nebenwirkung ist eine Verlängerung des QT-Intervalls mit dem Risiko eines QT-Syndroms. Ein Wirkstoff mit geringeren allergischen Auswirkungen soll Degarelix sein.
Sonstige Informationen
Plenaxis wurde 2003 in den USA von der FDA zugelassen; der damalige Hersteller, Praecis Pharmaceuticals, verzichtete aber 2005 auf die weitere Vermarktung. 2005 erteilte das BfArM eine Zulassung für Deutschland, ohne dass das Produkt auf den Markt gebracht wurde. 2007 erwarb das 2006 gegründete Unternehmen Speciality European Pharma die Rechte an dem Arzneimittel, seit Februar 2008 wird es in Deutschland vertrieben. Eine Zulassung in anderen EU-Mitgliedstaaten oder der Schweiz liegt bisher nicht vor.
Literatur
- McLeod D, Zinner N, Tomera K, Gleason D, Fotheringham N, Campion M, Garnick MB; Abarelix Study Group. A phase 3, multicenter, open-label, randomized study of abarelix versus leuprolide acetate in men with prostate cancer. In: Urology. 2001 Nov;58(5):756-61. PMID 11711355
- Artikel zu Abarelix in der Pharmazeutischen Zeitung
- Artikel zu Abarelix im Deutschen Ärzteblatt
- Verschreibungsinformationen der FDA zu Abarelix (englisch) (Memento vom 13. Mai 2009 im Internet Archive)