Degarelix
Degarelix ist ein synthetisches Peptid, das zur Behandlung des fortgeschrittenen hormonabhängigen Prostatakarzinoms eingesetzt wird. Es ist ein sogenannter GnRH-Antagonist, der eine schnelle Senkung des Testosteronspiegels innerhalb weniger Tage herbeiführt und somit eine ähnliche Sofortwirkung wie eine Orchiektomie erzielt.[2] Man spricht in diesem Zusammenhang von einer Androgen-Deprivations-Therapie (ADT). Die primäre Alternative zum GnRH-Antagonisten, die LHRH-Agonisten, benötigen zur gleichwertigen Senkung der Sexualhormonspiegel vier Wochen.[3]
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Degarelix | |||||||||||||||||||||
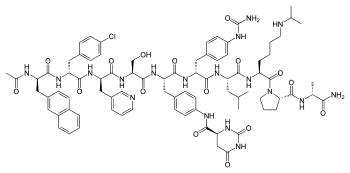
| Summenformel | C82H103ClN18O16 | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code |
L02BX02 | |||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 1692,31 g·mol−1 | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Das Medikament ist seit Dezember 2008 in den USA zugelassen.[4] Im Februar 2009 erteilte die Europäische Arzneimittel-Agentur dem Unternehmen Ferring Pharmaceuticals die Genehmigung für das Inverkehrbringen von Degarelix (Handelsname Firmagon®) in der gesamten Europäischen Union.
Wirkungsmechanismus
Degarelix ist dem körpereigenen Gonadotropin-Releasing-Hormone (GnRH) nachempfunden und wirkt als GnRH-Antagonist. Der Wirkstoff blockiert direkt die Rezeptoren im Vorderlappen der Hirnanhangdrüse und führt so innerhalb weniger Tage zu einer schnellen, deutlichen und langanhaltenden Senkung des Testosteronspiegels. Ein initialer Testosteronanstieg wie bei den LHRH-Agonisten bleibt hier aus.
Nach der Gabe von Degarelix wurde bei 99 % der Patienten der Testosteronspiegel innerhalb einer Woche unter Kastrationsniveau gesenkt.[5]
Studienergebnisse
Epidemiologische Daten haben gezeigt, dass es unter einer Androgen-Deprivations-Therapie zu einer Veränderung des Stoffwechsels (Herabsetzung der Glukosetoleranz oder zur Verschlechterung einer bestehenden Diabetes mellitus) kommt und dass ein erhöhtes Risiko für kardiovaskuläre Erkrankungen bestehen kann.[6] Studien konnten zeigen, dass ein GnRH-Antagonist im Vergleich zu LHRH-Agonisten das Risiko für kardiovaskuläre Ereignisse während der Androgen-Deprivations-Therapie um rund 50 % senken konnte.[7][8][9] Da ca. 33 % aller Patienten mit hormonsensitivem Prostatakrebs bereits vor der Behandlung kardiovaskuläre Risiken und/oder Erkrankungen aufweisen ist die Behandlung mit einem GnRH-Antagonisten für diese Risikogruppe geeignet.[10][11]
Das Prostatakarzinom metastasiert vorrangig in die lokalen Lymphknoten oder in das Skelett (Knochenmetastasen). Testosteron fördert das Wachstum der Krebszellen und somit das Größenwachstum des Tumors und der Metastasen.
Ein schnelles und direktes Absenken des Testosteronspiegels kann sich dadurch positiv auf die mit Knochenmetastasen verbundenen Schmerzen auswirken. Studien haben gezeigt, dass eine 50 % höhere Wahrscheinlichkeit der Schmerzfreiheit unter Degarelix im Vergleich zu LHRH-Agonisten (Goserelin) besteht.[11]
Nebenwirkungen
Bei einer ADT mit Degarelix können Nebenwirkungen auftreten. Viele davon sind direkt mit der schnellen Absenkung des Testosteron-Spiegels verbunden und stellen typische Reaktionen des Körpers auf den Hormonentzug dar. Das Auftreten dieser Nebenwirkungen zeigt aber auch, dass die Therapie erfolgreich anschlägt.
Sehr häufig treten Hitzewallungen und Reaktionen an der Injektionsstelle auf.[2]
Weblinks
- EUROPÄISCHER ÖFFENTLICHER BEURTEILUNGSBERICHT (EPAR) für FIRMAGON, Stand: 11. August 2009 auf der Website der Europäischen Arzneimittelagentur EMA, Abgerufen am 19. Februar 2016.
- Einträge im NIH-Studienregister
Einzelnachweise
- Für diesen Stoff liegt noch keine harmonisierte Einstufung vor. Wiedergegeben ist eine von einer Selbsteinstufung durch Inverkehrbringer abgeleitete Kennzeichnung von [No public or meaningful name is available] im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 13. Januar 2020.
- Fachinformation zu Firmagon von Ferring, Stand der Information: September 2013.
- Dirk Manski: Antiandrogene Hormontherapie: Degarelix und Abarelix (LHRH-Antagonisten), auf Urologielehrbuch.de.
- PR Newswire: FDA approves Ferring Pharmaceuticals' Degarelix (generic name) for the treatment of advanced prostate cancer. PR Newswire, Europe Ltd 2008, abgerufen am 2. März 2009.
- Klotz, L., Boccon-Gibod, L., Shore, N. D., Andreou, C., Persson, B.-E., Cantor, P., Jensen, J.-K., Olesen, T. K., Schröder, F. H.: The efficacy and safety of degarelix: a 12-month, comparative, randomized, open-label, parallel-group phase III study in patients with prostate cancer. In: BJU Int. 102 (2008), S. 1531–1538.
- Fachinformation zu Trenantone von Takeda, Stand: August 2018.
- Anderson M et al.: Management of advanced prostate cancer: can we improve on androgen deprivation therapy? In: British Association of Urological Surgeons (Hrsg.): BJU International. Nr. 101. Wiley-Blackwell-Verlag, S. 1497–1501.
- Lehmann J et al. Influence of cardiovascular (CV) comorbidities on the selection of hormone deprivation therapy (HDT) in the treatment of metastatic prostate cancer (mPCa). Poster präsentiert auf dem Genitourinary Cancers Symposium, San Francisco, February 8-10, 2018.
- Albertsen PC et al.: Cardiovascular morbidity associated with gonadotropin releasing hormone agonists and an antagonist. In: European Association of Urology (Hrsg.): Eur. Urol. Band 65, Nr. 3. Elsevier-Verlag, S. 565–573.
- Eisenhardt A et al. Cardiovascular comorbidities in German prostate cancer patients under androgen deprivation therapy. Resuslt from a retrospective analysis of patient data in urological outpatient centers. Poster präsentiert auf dem Genitourinary Cancers Symposium, San Francisco, February 8-10, 2018.
- Tombal B et al.: Efficacy and safety of a 3-monthly depot of degarelix compared with goserelin in prostate cancer. In: European Urology Supplements. Band 11, Nr. 5, 2012, S. 228.