γ-Decalacton
γ-Decalacton ist das Lacton der γ-Hydroxydecansäure und kommt in verschiedenen Lebensmitteln als Aromastoff vor. Dabei sind zwei chirale Konfigurationen zu unterscheiden (siehe Cahn-Ingold-Prelog-Konvention):
- (R)-(+)-γ-Decalacton besitzt ein pfirsichartiges, fruchtiges Aroma
- (S)-(−)-γ-Decalacton besitzt ein kokosartiges, fettiges Aroma[7]
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
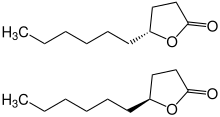 | ||||||||||||||||
| (R)-Isomer (oben) und (S)-Isomer (unten) | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | γ-Decalacton | |||||||||||||||
| Andere Namen | ||||||||||||||||
| Summenformel | C10H18O2 | |||||||||||||||
| Kurzbeschreibung |
farblose bis leicht gelbliche Flüssigkeit mit fruchtigem Geruch[3] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 170,25 g·mol−1 | |||||||||||||||
| Aggregatzustand |
flüssig | |||||||||||||||
| Dichte |
0,952 g·cm−3[1] | |||||||||||||||
| Siedepunkt |
281 °C[3] | |||||||||||||||
| Löslichkeit | ||||||||||||||||
| Brechungsindex |
1,4489[6] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
Vorkommen

In der Natur kommt größtenteils (R)-(+)-γ-Decalacton vor[1], wobei der Enantiomerenüberschuss oft über 80 % liegt.[8] Dieses ist für das Aroma von Aprikosen (Marillen, Prunus armeniaca) ausschlaggebend und ist – zusammen mit anderen Lactonen – auch für das Aroma von Pfirsichen (Prunus persica) prägend.[9] Aber auch in anderem Obst, z. B. in Ananas, Erdbeeren, Maracuja und Mango, ist (R)-(+)-γ-Decalacton als Aromastoff enthalten.[8]
Das Aroma von Camembert enthält γ-Decalacton.[9] Allerdings ist für den Geschmack von Käse das δ-Decalacton wichtiger.[10]
Herstellung
(R)-γ-Decalacton wird mit Hilfe von Mikroorganismen (Hefen und Pilze wie Candida, Monilia, Sporobolomyces u. a.) fermentativ über die Zwischenstufe Ricinolsäure aus Ricinusöl gewonnen und Lebensmitteln zugesetzt.[11] Seltener wird γ-Decalacton aus Decansäureethylester (oft isoliert aus Kokosnußöl) mittels Mucor circinelloides erzeugt. Synthetisch kann γ-Decalacton aus 3-Bromdecansäure nach Erhitzen mit Natriumcarbonat gewonnen werden.[1]
Einzelnachweise
- Eintrag zu Decanolactone. In: Römpp Online. Georg Thieme Verlag, abgerufen am 31. August 2015.
- Eintrag zu GAMMA-DECALACTONE in der CosIng-Datenbank der EU-Kommission, abgerufen am 1. Oktober 2021.
- Datenblatt γ-Decalactone, ≥98% bei Sigma-Aldrich, abgerufen am 3. Februar 2018 (PDF).
- Laurette Tavel, Isabelle Andriot, Céline Moreau, Elisabeth Guichard: Interactions between β-Lactoglobulin and Aroma Compounds: Different Binding Behaviors as a Function of Ligand Structure. 18. Oktober 2008, doi:10.1021/jf801841u.
- Datenblatt [https://de.wikipedia.org/w/index.php?title=Wikipedia:Defekte_Weblinks&dwl=http://www.lansdownearomatics.com/assets/Naturals-pdf/GAMMA%20DECALACTONE.pdf Seite nicht mehr abrufbar], Suche in Webarchiven: [http://timetravel.mementoweb.org/list/2010/http://www.lansdownearomatics.com/assets/Naturals-pdf/GAMMA%20DECALACTONE.pdf γ-Decalacton] (PDF; 51 kB) bei Lansdowne Aromatics, abgerufen am 2. April 2012.
- M. S. Kharasch, P. S. Skell, Paul Fisher: Reactions of Atoms and Free Radicals in Solution. XII. The Addition of Bromo Esters to Olefins. In: Journal of the American Chemical Society. Band 70, Nr. 3, 19. März 1948, ISSN 0002-7863, S. 1055–1059, doi:10.1021/ja01183a053.
- W. Ternes: Naturwissenschaftliche Grundlagen der Lebensmittelzubereitung. 3. Auflage. Behr’s Verlag, Hamburg 2008, S. 316 (eingeschränkte Vorschau in der Google-Buchsuche).
- Hans-Dieter Belitz, Werner Grosch, Peter Schieberle: Food Chemistry. 4. Auflage. Springer Science & Business Media, Berlin Heidelberg 2009, ISBN 978-3-540-69933-0, 5.2 Aroma Analysis, S. 355, doi:10.1007/978-3-540-69934-7 (englisch, eingeschränkte Vorschau in der Google-Buchsuche [abgerufen am 23. August 2016] Enantiomerenüberschuss >80%).
- Kathrin Verena Eisinger: Aromastoffe in ausgewählten alltäglichen Lebensmitteln. Diplomarbeit, Universität Wien, Fakultät für Lebenswissenschaften, BetreuerIn: Dorota Majchrzak. Hrsg.: Universität Wien. Wien Dezember 2008, 3.1.2.1. Marille, 3.3.3. Marillensaft, 3.3.4. Pfirsichsaft, 3.4.4.1.4. Weichkäse, S. 52–53, 89–91, 115–116, 127, 129 (online [PDF; 1,5 MB; abgerufen am 23. August 2016]).
- Leo M.L. Nollet, Fidel Toldra: Handbook of Dairy Foods Analysis. CRC Press, Taylor & Francis, Boca Raton 2009, ISBN 978-1-4200-4632-8, 12.3.3 Lipolysis and Catabolism of Fatty Acids, S. 288 (englisch, eingeschränkte Vorschau in der Google-Buchsuche [abgerufen am 23. August 2016]).
- U.-J. Salzer, F. Siewek (Hrsg.): Handbuch Aromen und Gewürze. Behr’s Verlag, Hamburg 1999, S. 20–21 (eingeschränkte Vorschau in der Google-Buchsuche).