Zinkperoxid
Zinkperoxid ist ein weißlicher bis hellgelber Feststoff und ein starkes Oxidationsmittel.
| Kristallstruktur | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
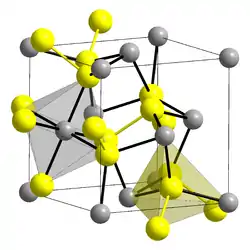 | ||||||||||||||||
| _ Zn2+ _ O22− | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Zinkperoxid | |||||||||||||||
| Andere Namen | ||||||||||||||||
| Verhältnisformel | ZnO2 | |||||||||||||||
| Kurzbeschreibung |
weißer bis gelblicher, geruchloser Feststoff[2] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 97,39 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Dichte |
1,57 g·cm−3[2] | |||||||||||||||
| Schmelzpunkt |
zersetzt sich beim Erhitzen[2] | |||||||||||||||
| Löslichkeit |
löslich unter Hydrolyse in Wasser[2] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Gewinnung und Darstellung
Zinkperoxid lässt sich durch Umsetzung von Zinkoxid mit Wasserstoffperoxid gewinnen, wobei das Produkt Kristallwasser enthält. Auch eine Herstellung aus anderen Zinksalzen und Wasserstoffperoxid ist möglich. Wasserfreies Zinkperoxid erhält man durch Umsetzung von Zinknitrat mit Kaliumperoxid in flüssigem Ammoniak. Die letzteren beiden Methoden führen allerdings zu einem weniger reinen Produkt.[3]
Eigenschaften
Die chemischen Eigenschaften des Zinkperoxids ähneln denen des Magnesiumperoxids.[3]
Bei Temperaturen über 150 °C zersetzt sich Zinkperoxid zu Zinkoxid und Sauerstoff, bei 212 °C läuft diese Reaktion explosiv ab:[2]
Verwendung
Zinkperoxid wird zur Herstellung blei-, antimon- und bariumfreier SINTOX-Anzündsätze eingesetzt.[4] Außerdem ist Zinkperoxid ein Bestandteil von Zahnbleichmitteln.[5]
Sicherheitshinweise
Als starkes Oxidationsmittel ist Zinkperoxid brandfördernd. Mechanische Einwirkung oder Erhitzen kann zu explosiven Reaktionen führen, ebenso neigen Mischungen mit brennbaren Stoffen zur – möglicherweise explosiven – Selbstentzündung.[6]
Einzelnachweise
- Eintrag zu ZINC PEROXIDE in der CosIng-Datenbank der EU-Kommission, abgerufen am 25. September 2021.
- Eintrag zu Zinkperoxid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 9. Januar 2019. (JavaScript erforderlich)
- F. Albert Cotton (Hrsg.): Progress in Inorganic Chemistry. Band 4. John Wiley & Sons, 2009, ISBN 978-0-470-16655-0, S. 146 (englisch).
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 47–48.
- blv.admin.ch: Zahnbleichmittel, 13. März 2013.
- Zinc Peroxide bei cameochemicals.noaa.gov, abgerufen am 27. Januar 2019.


