Vinculin
Vinculin (aus dem lat. 'vinculum' für Fessel) ist ein 116 kDa großes Protein, das man in fast allen Zellen von Tieren findet. Es bindet Aktin, ein Strukturprotein, und ist Bestandteil von Zell-Zell-Verbindungen, den sogenannten Adherens Junctions und auch von Zell-Extrazellulären Kontakten, die in der Gruppe der Fokalen Adhäsionen zusammengefasst werden.[2]
| Vinculin | ||
|---|---|---|
|
Vorhandene Strukturdaten: 1tr2 | ||
| Eigenschaften des menschlichen Proteins | ||
| Masse/Länge Primärstruktur | 1133 Aminosäuren | |
| Isoformen | 3 | |
| Bezeichner | ||
| Gen-Name | VCL | |
| Externe IDs | ||
| Vorkommen | ||
| Übergeordnetes Taxon | mehrzellige Tiere[1] | |
Dort ist es das Hauptstrukturprotein, d. h. es hat hauptsächlich Funktionen im Aufbau und der Verknüpfung von Proteinen und Zellen aber nicht im Stoffwechsel. Es wurde zuerst in glatten Muskelzellen gefunden und ist seitdem in den meisten anderen Zellarten der Säugetiere nachgewiesen worden.[3]
Beim Menschen können Mutationen im VCL-Gen zu Vinculinmangel, und dieser zu dilatativer Kardiomyopathie Typ I führen.[4]
Es wurde unabhängig durch Benny Geiger und Keith Burridge 1979 entdeckt.[5][6]
Struktur
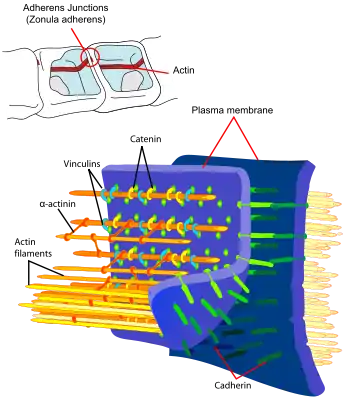
Allgemein:
- Vinculin kann man sich als dreigeteiltes Protein vorstellen: Kopf – Verbindungsteil – Schwanz
- Im Verbindungsteil liegen Bindestellen für andere Proteine; d. h. dort können andere Proteine "andocken"
- Proteine, die an Vinculin binden können, sind z. B. Talin, Catenine, Aktin, Paxillin.
- Kopf und Schwanz des Vinculins können sich miteinander lose verbinden und die Stellen im Verbindungsteil für andere Proteine unzugänglich machen.
Im Detail:
Vinculin besitzt einen globulären Kopf, der mittels einer prolinreichen Region mit der Enddomäne verbunden ist. In allen Regionen des Proteins befinden sich zahlreiche Bindestellen für andere Proteine. Am besten charakterisiert wurde die Bindestelle des Talins, welches offenbar Teile des β-Integrins mit dem Aktinnetz koppelt und so verantwortlich ist für Integrin-Aktivierung und focal adhesion-Zusammenbau.[7]
Interessanterweise können Kopf und Ende des Vinculins miteinander assoziieren und so etliche Bindestellen maskieren.[8] Ein aktives Vinculin besteht möglicherweise aus dissoziierten Domänen und auf diese Weise frei verwendbaren Bindestellen, obwohl wahrscheinlich auch andere Konformationen möglich sind.
Funktionen
Allgemeiner kurzer Überblick:
- Vinculin ist ein Strukturprotein und wird von der Zelle hauptsächlich für den Aufbau von Zellkontakten und Zell-Matrix Kontakten benutzt.
- Vinculin wirkt als Tumorsuppressor, d. h. das Fehlen des Proteins kann die Entstehung von Tumoren begünstigen
- Vinculin besitzt offenbar eine Funktion in der Einleitung des programmierten Zelltodes (Apoptose)
- Vinculin beeinflusst den Aufbau des Aktinzytoskeletts (das stützende Gerüst der Zelle)
- Vinculin kann andere Proteine vor Abbau schützen und wirkt so wohl als Tumorsuppressor
Im Detail:
Die genaue Rolle, die Vinculin in „focal adhesions“ spielt ist noch unklar. Vinculin Überexpression reduziert die Zellbewegung, wohingegen die Vinculin Hemmung die Zellbewegung stimuliert. Zellen ohne Vinculin (Vinculin-KOs) sind weniger adhärent, weniger ausgebreitet, beweglicher und haben kleinere und weniger "focal adhesions" als normale Zellen.[9]
Außerdem ist dort die Aktivität solcher Proteine wie FAK (focal adhesion kinase) und paxillin erhöht, was typisch für bewegliche Zellen ist. Vinculin ist auch ein Tumorsuppressor.[10]
Offenbar besitzt Vinculin auch Funktionen im Apoptose-Signalweg, denn Zellen einer Vinculin KO Maus sind resistent gegenüber Apoptose.[11]
Obwohl Vinculin vor allem in Cadherin vermittelten Zell-Zell Verbindungen ("adherens junctions") zu finden ist, ist es nicht nötig um diese Verbindungen aufzubauen. Allerdings wurden Defekte in den "tight junctions" der Vinculin-KO Zellen gefunden.[12]
Man nahm an, dass Vinculin die mechanischen Verbindungen zwischen den Protein-Komplexen (bestehend aus E-cadherin, beta-catenin, alpha-catenin) und dem Aktinnetz stärkt. Diese Theorie wird jedoch durch jüngste Studien in Frage gestellt.[13]
Offenbar existiert nur eine lose Verbindung des Aktin-Zytoskeletts mit den Zell-Zell Verbindungen, sodass die Rolle Vinculins immer noch ungeklärt ist. Neue Daten zeigen jedoch den Einfluss auf den Aktinzusammenbau und Modifizierung.[14]
Außerdem ist es bemerkenswert, dass KO-Zellen, die kein Vinculin mehr besitzen, kein PTEN (eine Lipidphosphatase) exprimieren. Offenbar kann Vinculin den Abbau PTENs stoppen, da die mRNA Menge unverändert zu der in normalen Zellen ist. PTEN gehört zu den am häufigsten mutierten Tumorsuppressorgenen. Es gibt Tumore, in denen keine Mutationen gefunden wurde aber das PTEN trotzdem nicht vorhanden war. Hier ist es möglich, dass durch Vinculin-Mutationen der Abbau des PTEN nicht verhindert wird und so Tumorentstehung begünstigt wird.[15]
Einzelnachweise
- Homologe bei OMA
- Ziegler, et al.: The structure and regulation of vinculin. Trends in Cell Biology Vol.16 No.9 453ff, 2009 PMID 16893648
- JOCKUSCH, B. M. et al.: The molecular architecture of focal adhesions. (1995) Annu. Rev. Cell Dev. Biol. 11, 379–416 PMID 8689563
- UniProt P18206
- Geiger, A 130K protein from chicken gizzard: its localization at the termini of microfilament bundles in cultured chicken cells. Cell, Band 18, 1979, S. 193–205, PMID 574428
- K. Burridge, J. R. Feramisco: Microinjection and localization of a 130K protein in living fibroblasts: a relationship to actin and fibronectin, Cell, Band 19, 1980, S. 587–95. PMID 6988083.
- Critchley, D.R. (2000) Focal adhesions – the cytoskeletal connection.Curr. Opin. Cell Biol. 12, 133–139
- Johnson, R.P. and Craig, S.W. (1994) An intramolecular association between the head and tail domains of vinculin modulates talin binding. J. Biol. Chem. 269, 12611–12619
- Xu, W. et al. (1998) Vinculin knockout results in heart and brain defects during embryonic development. Development 125, 327–337
- Rodriguez Fernandez, J.L. et al. (1992) Suppression of tumorigenicity in transformed cells after transfection with vinculin cDNA. J. Cell Biol. 119, 427–438
- Coll, J.L. et al. (1995) Targeted disruption of vinculin genes in F9 and embryonic stem cells changes cell morphology, adhesion, and locomotion. Proc. Natl. Acad. Sci. U. S. A. 92, 9161–9165
- Watabe-Uchida, M. et al. (1998) alpha-Catenin-vinculin interaction functions to organize the apical junctional complex in epithelial cells. J.Cell Biol. 142, 847–857
- Yamada, S. et al. (2005) Deconstructing the cadherin-catenin-actin complex. Cell 123, 889–90
- Wen KK, Rubenstein PA, DeMali KA. J Biol Chem. 2009 Oct 30;284(44):30463-73 Vinculin nucleates actin polymerization and modifies actin filament structure
- Subauste, M.C. et al. (2005) Vinculin controls PTEN protein level by maintaining the interaction of the adherens junction protein betacatenin with the scaffolding protein MAGI-2. J. Biol. Chem. 280, 5676–5681