Vemurafenib
Vemurafenib ist der internationale Freiname für eine synthetisch hergestellte chemische Verbindung aus der Gruppe der Sulfonamide. Im August 2011 wurde der Arzneistoff mit Proteinkinaseinhibitor-Wirkung unter dem Handelsnamen Zelboraf für die Behandlung des malignen Melanoms in den USA zugelassen. Die Substanz wurde von Roche und Plexxikon entwickelt. Plexxikon wurde im April 2011 von Daiichi-Sankyo gekauft, so dass diese beiden Firmen Zelboraf gemeinsam vermarkten.[2][3][4][5]
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
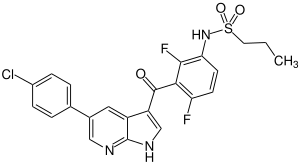 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Freiname | Vemurafenib | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C23H18ClF2N3O3S | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 489,92 g·mol−1 | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Wirkmechanismus
Vemurafenib ist ein selektiver Inhibitor des Onkogens B-Raf, einer Serin/Threonin-Kinase. In einer Reihe von Krebserkrankungen wird das Onkogen B-Raf in den Tumorzellen aktiviert. Beim malignen Melanom ist dies in etwa 70 %, beim Schilddrüsenkrebs zu 30 bis 70 %, beim Ovarialkarzinom zu 15 bis 30 % und beim kolorektalen Karzinom zu 5 bis 20 % der Erkrankungen der Fall.[6] Mutationen in B-Raf bewirken eine erhöhte Kinaseaktivität, was eine Überaktivierung des mitogenaktivierten Proteinkinase-Wegs zur Folge hat. In Modellorganismen mit xenotransplantatierten malignen Melanomen konnte mit Vemurafenib B-Raf deaktiviert und eine Regression der Tumoren beobachtet werden. Die Deaktivierung von B-Raf bewirkt in den Tumorzellen deren Apoptose.[6]
Etwa 50 % der humanen malignen Melanome weisen die Mutation V600E in B-Raf auf. Nur bei diesem Genotyp wirkt Vemurafenib. Bei diesem Mutationstyp ist in der Position 600 an Stelle von Valin (V) Glutaminsäure (E) in das B-Raf-Protein eingebaut. Aus den Ergebnissen früher klinischer Studien (Phase I und II) wurde bei einigen Patienten ein zeitlich begrenztes Ansprechen des Tumors auf den Wirkstoff festgestellt, das heißt, dass sich nach einer bestimmten Behandlungsdauer eine Resistenz der Tumorzellen gegenüber Vemurafenib einstellt. Als Ursache für die Resistenzbildung wird ein „Umschalten“ der Tumorzellen auf einen anderen Signalweg vermutet.[7] So wurde bei einigen Zellen mit Resistenzbildung eine verstärkte Expression von PDGFRB (ein Platelet Derived Growth Factor Rezeptor) beobachtet, wodurch ein alternativer Überlebensweg (an Stelle von B-Raf) eingeschlagen wurde. Bei anderen resistenten Zellen wurde die Aktivierung des Onkogens NRAS (Neuroblastom-RAS) festgestellt, was den normalen B-RAF-Überlebensweg wieder aktiviert.[8]
Das IC50 gegenüber V600E-Mutanten liegt bei 44 nmol/L,[6] während es bei Zellen vom Wildtyp bei über 2,4 µmol/L liegt.[9]
Nebenwirkungen
Im August 2013 wies der Hersteller Roche in einem Rote-Hand-Brief auf Risiko für eine Progression maligner Erkrankungen und Arzneimittelausschlag mit Eosinophilie und systemischen Symptomen (DRESS-Syndrom) in Verbindung mit Zelboraf® (Vemurafenib) hin.[10]
Die Kombination mit Strahlentherapie beim Melanom kann zur Cutis verticis gyrata führen.[11]
Zulassung
Die US-amerikanische Food and Drug Administration (FDA) hat im August 2011 Zelboraf® (Vemurafenib) für die Behandlung von Patienten mit inoperablem oder metastasiertem Melanom und einer BRAF-V600-Mutation zugelassen.[12] im Februar 2012 folgte die Zulassung durch die EU-Kommission für den europäischen Markt.[13] In Deutschland hat das Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG) den Zusatznutzen von Vemurafenib überprüft. Demnach stehen im Vergleich mit Dacarbazin erhebliche Vorteile in Bezug auf das Gesamtüberleben jedoch gravierende Nebenwirkungen gegenüber. Insgesamt ergibt sich ein Hinweis auf einen beträchtlichen Zusatznutzen.[14]
Vemurafenib befindet sich derzeit in der klinischen Phase II bei Patienten mit malignem Melanom mit Hirnmetastasen.[15]
Literatur
- K. S. Smalley: PLX-4032, a small-molecule B-Raf inhibitor for the potential treatment of malignant melanoma. In: Current Opinion in Investigational Drugs, Band 11, Nummer 6, Juni 2010, S. 699–706, PMID 20496265. (Review).
- C. A. Pratilas, D. B. Solit: Targeting the mitogen-activated protein kinase pathway: physiological feedback and drug response. In: Clinical Cancer Research, Band 16, Nummer 13, Juli 2010, S. 3329–3334, doi:10.1158/1078-0432.CCR-09-3064. PMID 20472680. PMC 291221 (freier Volltext). (Review).
- C. Shepherd, I. Puzanov, J. A. Sosman: B-RAF inhibitors: an evolving role in the therapy of malignant melanoma. In: Current Oncology Reports, Band 12, Nummer 3, Mai 2010, S. 146–152, doi:10.1007/s11912-010-0095-2. PMID 20425073. (Review).
- C. Wellbrock, A. Hurlstone: BRAF as therapeutic target in melanoma. In: Biochemical Pharmacology, Band 80, Nummer 5, September 2010, S. 561–567, doi:10.1016/j.bcp.2010.03.019. PMID 20350535. (Review).
Weblinks
- Malignes Melanom – Neue Hoffnung für Hautkrebspatienten. In: Focus Online, 15. Juli 2011
Einzelnachweise
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- Plexxikon Announces European Approval of Zelboraf(R) for the Treatment of Patients with BRAF Mutation-Positive Metastatic Melanoma. Pressemeldung von Daiichi-Sankyo vom 20. Februar 2012, abgerufen am 6. September 2013.
- Neue Arzneimittel: Zelboraf® (Vemurafenib) (PDF; 123 kB) Information der Arzneimittelkommission der deutschen Ärzteschaft (AkdÄ), Stand: 12. Juni 2012.
- Zelboraf EPAR - Summary for the public. Europäische Arzneimittelagentur (EMA); abgerufen am 6. September 2013 (englisch).
- Zusammenfassung des EPAR für die Öffentlichkeit. (PDF; 113 kB) EMA (deutsch) abgerufen am 6. September 2013.
- E. Sala, L. Mologni, S. Truffa, C. Gaetano, G. E. Bollag, C. Gambacorti-Passerini: BRAF silencing by short hairpin RNA or chemical blockade by PLX4032 leads to different responses in melanoma and thyroid carcinoma cells. (Memento vom 2. Februar 2016 im Internet Archive) In: Molecular Cancer Research Band 6, Nummer 5, Mai 2008, S. 751–759, doi:10.1158/1541-7786.MCR-07-2001. PMID 18458053.
- E. Livingstone, L. Zimmer, S. Piel, D. Schadendorf: PLX4032: does it keep its promise for metastatic melanoma treatment? In: Expert Opinion on Investigational Drugs Band 19, Nummer 11, November 2010, S. 1439–1449, doi:10.1517/13543784.2010.527945. PMID 20942773. (Review).
- R. Nazarian, H. Shi, Q. Wang, X. Kong, R. C. Koya, H. Lee, Z. Chen, M. K. Lee, N. Attar, H. Sazegar, T. Chodon, S. F. Nelson, G. McArthur, J. A. Sosman, A. Ribas, R. S. Lo: Melanomas acquire resistance to B-RAF(V600E) inhibition by RTK or N-RAS upregulation. In: Nature Band 468, Nummer 7326, Dezember 2010, S. 973–977, doi:10.1038/nature09626. PMID 21107323.
- R. Halaban, W. Zhang, A. Bacchiocchi, E. Cheng, F. Parisi, S. Ariyan, M. Krauthammer, J. P. McCusker, Y. Kluger, M. Sznol: PLX4032, a selective BRAF(V600E) kinase inhibitor, activates the ERK pathway and enhances cell migration and proliferation of BRAF melanoma cells. In: Pigment Cell & Melanoma Research Band 23, Nummer 2, April 2010, S. 190–200, doi:10.1111/j.1755-148X.2010.00685.x. PMID 20149136. PMC 284897 (freier Volltext).
- Rote-Hand-Brief von Roche am 30. August 2013. (PDF; 127 kB) Abgerufen am 5. September 2013.
- emedicine
- FDA erteilt Zulassung für Zelboraf (Vemurafenib) und Begleittest für BRAF-Mutation-positives metastasierendes Melanom, einer tödlichen Form von Hautkrebs, Pressemeldung Roche vom 22. August 2011
- Roche erhält EU-Zulassung für Hautkrebs-Medikament. NZZ Online, 27. Februar 2012.
- Anna-Sabine Ernst: Hinweis auf beträchtlichen Zusatznutzen von Vemurafenib bei fortgeschrittenem Melanom. Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG), Pressemitteilung vom 15. Juni 2012 beim Informationsdienst Wissenschaft (idw-online.de), abgerufen am 24. August 2015.
- Klinische Studie (Phase II): A Study of Vemurafenib in Metastatic Melanoma Patients With Brain Metastases bei Clinicaltrials.gov der NIH