Ubiquitin-Protein-Ligasen
Ubiquitin-Protein-Ligasen, synonym Ubiquitinligasen, sind Enzyme aus der Gruppe der Ligasen.
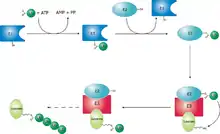
Eigenschaften
Ubiquitin-Protein-Ligasen katalysieren die Übertragung des Proteins Ubiquitin auf ein anderes Protein. Das entstehende Ubiquitin-gekoppelte (fachsprachlich ubiquitinylierte oder ubiquitinierte)[1][2] Protein wird unter anderem vom Ubiquitin-Proteasom-System gebunden und abgebaut oder – je nach behängtem Protein und je nach Anzahl der angehängten Ubiquitine – reguliert einen zellulären Vorgang wie die Endozytose, die Transkription, den Proteintransport in Peroxisomen oder den Zellzyklus.[2][3]
Die Ubiquitin-Protein-Ligasen kommen in allen Zellen vor (ubiquitär) und koppeln Ubiquitin an ein Protein in einem dreistufigen Prozess mit drei verschiedenen Ubiquitin-Protein-Ligasen.[1] Im ersten Schritt katalysiert eine E1-Ubiquitin-Protein-Ligase unter Hydrolyse von Adenosintriphosphat (ATP) die Bindung der Carboxygruppe (COOH-Gruppe) des C-terminalen Glycins eines Ubiquitins auf eine Thiolgruppe (SH-Gruppe) eines bestimmten Cysteins auf der Oberfläche der E1-Ubiquitin-Protein-Ligase.[1] Anschließend überträgt die E1-Ubiquitin-Protein-Ligase das Ubiquitin auf die Thiolgruppe eines bestimmten Cysteins der E2-Ubiquitin-Protein-Ligase.[1] In den beiden ersten Schritten erfolgt die enzymatische Übertragung des Ubiquitins auf die Enzyme selbst, während im dritten Schritt eine E3-Ubiquitin-Protein-Ligase die Übertragung des Ubiquitins von der E2-Ubiquitin-Protein-Ligase auf die ε-Aminogruppe eines bestimmten Lysins auf der Oberfläche des zu markierenden Proteins katalysiert.[1][4]
Beispiele
Ubiquitin-Protein-Ligasen sind beispielsweise E3A, mdm2, Anaphase-promoting complex (APC), UBR5 (EDD1), SOCS, LNXp80, CBX4, CBLL1, HACE1, HECTD1, HECTD2, HECTD3, HECTD4, HECW1, HECW2, HERC1, HERC2, HERC3, HERC4, HERC5, HERC6, HUWE1, ITCH, NEDD4, NEDD4L, PPIL2, PRPF19, PIAS1, PIAS2, PIAS3, PIAS4, RANBP2, RNF4, RBX1, SMURF1, SMURF2, STUB1, TOPORS, TRIP12, UBE3A, UBE3B, UBE3C, UBE3D, UBE4A, UBE4B, UBOX5, UBR1, UBR5, WWP1, WWP2 und Parkin.
Einzelnachweise
- Werner Müller-Esterl: Biochemie. Springer-Verlag, 2017, ISBN 978-3-662-54851-6, S. 252.
- Peter C. Heinrich: Löffler/Petrides Biochemie und Pathobiochemie. Springer-Verlag, 2014, ISBN 978-3-642-17972-3, S. 624, 625.
- Leonardo K. Teixeira, Steven I. Reed: Ubiquitin ligases and cell cycle control. In: Annual Review of Biochemistry. Band 82, 2013, ISSN 1545-4509, S. 387–414, doi:10.1146/annurev-biochem-060410-105307, PMID 23495935.
- A. Hershko, A. Ciechanover: The ubiquitin system. In: Annual Review of Biochemistry. Band 67, 1998, ISSN 0066-4154, S. 425–479, doi:10.1146/annurev.biochem.67.1.425, PMID 9759494.