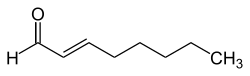
trans-2-Octenal
trans-2-Octenal ist eine chemische Verbindung aus der Gruppe der Alkenale, also einem Aldehyd mit einer zusätzlichen C-C-Doppelbindung.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Trans-2-Octenal | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C8H14O | |||||||||||||||
| Kurzbeschreibung |
farblose Flüssigkeit[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 126,20 g·mol−1 | |||||||||||||||
| Aggregatzustand |
flüssig[1] | |||||||||||||||
| Dichte |
0,846 g·cm−3 (25 °C)[1] | |||||||||||||||
| Siedepunkt |
84–86 °C (25 hPa)[1] | |||||||||||||||
| Löslichkeit | ||||||||||||||||
| Brechungsindex |
1,45 (20 °C)[1] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
Vorkommen
trans-2-Octenal kommt natürlich als wichtiger Aromastoff unter anderem in Pilzen[3] und Lammfleisch[4], sowie in verschiedenen Früchten wie Melonen[2] vor.
Eigenschaften
trans-2-Octenal ist eine farblose Flüssigkeit mit grünem zitrusähnlichem Geruch.[1][5]
Verwendung
trans-2-Octenal wird zur Synthese anderer chemischer Verbindungen verwendet.[6]
Einzelnachweise
- Datenblatt trans-2-Octenal, ≥94% bei Sigma-Aldrich, abgerufen am 9. Mai 2012 (PDF).
- Fontarome Chemical: [https://de.wikipedia.org/w/index.php?title=Wikipedia:Defekte_Weblinks&dwl=http://files.fontaromechemical.com/docs/13238_TechSpecs.pdf Seite nicht mehr abrufbar], Suche in Webarchiven: [http://timetravel.mementoweb.org/list/2010/http://files.fontaromechemical.com/docs/13238_TechSpecs.pdf MSDS] (Seite nicht mehr abrufbar, Suche in Webarchiven) Info: Der Link wurde automatisch als defekt markiert. Bitte prüfe den Link gemäß Anleitung und entferne dann diesen Hinweis. (PDF; 82 kB)
- Henry B. Heath: Source Book of Flavors. Springer, 1981, ISBN 978-0-87055-370-7, S. 269.
- Waldemar Ternes: Naturwissenschaftliche Grundlagen der Lebensmittelzubereitung. Behr's, 2008, ISBN 978-3-89947-422-0, S. 468.
- David Rowe: Chemistry and Technology of Flavours and Fragrances. John Wiley & Sons, 2009, ISBN 978-1-4051-4807-8, S. 71 (eingeschränkte Vorschau in der Google-Buchsuche).
- Sentaro Okamoto, Kandasamy Subburaj, Fumie Sato: Highly Stereocontrolled Synthesis of Carbacyclin from Acyclic Starting Materials via Ti(II)-Mediated Tandem Cyclization. In: Journal of the American Chemical Society. Band 122, Nr. 45, 2000, S. 11244–11245, doi:10.1021/ja002974x.
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. The authors of the article are listed here. Additional terms may apply for the media files, click on images to show image meta data.
