Silberiodat
Silberiodat ist eine anorganische chemische Verbindung des Silbers aus der Gruppe der Iodate.
| Kristallstruktur | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
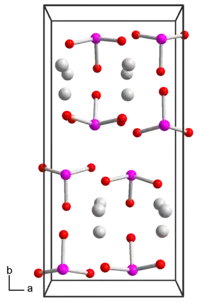 | |||||||||||||||||||
| _ Ag+ _ I5+ _ O2− | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Silberiodat | ||||||||||||||||||
| Andere Namen |
Silber(I)-iodat | ||||||||||||||||||
| Verhältnisformel | AgIO3 | ||||||||||||||||||
| Kurzbeschreibung |
lichtempfindlicher weißer geruchloser Feststoff[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 282,77 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest[1] | ||||||||||||||||||
| Dichte |
5,53 g·cm−3[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Löslichkeit | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Thermodynamische Eigenschaften | |||||||||||||||||||
| ΔHf0 |
−171,1 kJ/mol[3] | ||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Gewinnung und Darstellung
Silberiodat kann durch Reaktion einer Silbernitrat-Lösung mit Kaliumiodat gewonnen werden.[4] Es kann auch durch Reaktion von Kaliumiodat mit einer Silbersulfat- oder Silberdithionatlösung gewonnen werden.
Eigenschaften
Silberiodat ist ein weißer lichtempfindlicher Feststoff, der praktisch unlöslich in Wasser aber löslich in Ammoniakwasser ist.[1] Bei Erhitzung zersetzt er sich zu Silberiodid und Sauerstoff. Er besitzt eine orthorhombische Kristallstruktur mit der Raumgruppe Pbc21 (Raumgruppen-Nr. 29, Stellung 2).[2]
Einzelnachweise
- Datenblatt Silver iodate, 99% bei AlfaAesar, abgerufen am 10. November 2021 (PDF) (JavaScript erforderlich).
- Roger Blachnik (Hrsg.): Taschenbuch für Chemiker und Physiker. Band III: Elemente, anorganische Verbindungen und Materialien, Minerale. begründet von Jean d’Ans, Ellen Lax. 4., neubearbeitete und revidierte Auflage. Springer, Berlin 1998, ISBN 3-540-60035-3, S. 286 (eingeschränkte Vorschau in der Google-Buchsuche).
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-4.
- GMELIN's Handbuch der anorganischen Chemie, 8. Auflage, Verlag Chemie GmbH, Teil B2, Silber-Verbindungen Seite 434
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. The authors of the article are listed here. Additional terms may apply for the media files, click on images to show image meta data.

