Silberchromat
Silberchromat ist eine chemische Verbindung aus der Gruppe der Chromate.
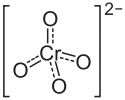
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Silberchromat | |||||||||||||||
| Andere Namen |
Silber(I)-chromat | |||||||||||||||
| Summenformel | Ag2CrO4 | |||||||||||||||
| Kurzbeschreibung |
rotbrauner Feststoff[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 331,73 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Dichte |
5,63 g·cm−3[2] | |||||||||||||||
| Löslichkeit |
nahezu unlöslich in Wasser[2] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Thermodynamische Eigenschaften | ||||||||||||||||
| ΔHf0 |
−731,7 kJ/mol[5] | |||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Gewinnung und Darstellung
Silberchromat kann durch Reaktion von Silbernitrat (AgNO3) und Kaliumchromat (K2CrO4) hergestellt werden. Beim Auftropfen von Silbernitratlösung auf ein chromathaltiges Gel entstehen periodische Ringe aus Silberchromat um die Auftropfstelle, welche nach ihrem Entdecker Raphael Eduard Liesegang als Liesegangsche Ringe bezeichnet werden.[6]
Eigenschaften
Silberchromat besitzt eine orthorhombische Kristallstruktur mit der Raumgruppe Pnma (Raumgruppen-Nr. 62) und den Gitterparametern a = 1006 pm, b = 703 pm und c = 554 pm.[7]
1798 entdeckte Louis-Nicolas Vauquelin die Lichtempfindlichkeit von Siberchromat.[8]
Verwendung
Silberchromat dient dank seiner charakteristischen rotbraunen Farbe als Reagenz bei Nachweisreaktionen. Es wird vor allem in der quantitativen Bestimmung von Chlorid durch Titration nach Mohr eingesetzt.[9]
Die Erzeugung Liesegangscher Ringe ist ein Beispiel für die Erzeugung periodischer Strukturen durch chemische Reaktion und wird dementsprechend als Demonstrationsversuch durchgeführt.
Siehe auch
- Silberdichromat Ag2Cr2O7
Einzelnachweise
- Jander, Blasius: Einführung in das anorganisch-chemische Praktikum. 14. Auflage. S. Hirzel Verlag, Stuttgart, Leipzig 1995, ISBN 3-7776-0672-3.
- Datenblatt Silver chromate (PDF) bei Fisher Scientific, abgerufen am 13. Februar 2014.
- Nicht explizit in Verordnung (EG) Nr. 1272/2008 (CLP) gelistet, fällt aber mit der angegebenen Kennzeichnung unter den Gruppeneintrag Chromium (VI) compounds, with the exception of barium chromate and of compounds specified elsewhere in this Annex im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Datenblatt Silver chromate bei Sigma-Aldrich, abgerufen am 12. Mai 2017 (PDF).
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-4.
- Oszillierende und periodische Reaktionen bei seilnacht.com
- Marvin L. Hackert, Robert A. Jacobson: The Crystal Structure of Silver Chromate. In: Journal of Solid State Chemistry, 1971, 3, S. 364–368, doi:10.1016/0022-4596(71)90072-7.
- Geschichte der Fotografie (englisch) (Memento vom 19. Juni 2008 im Internet Archive)
- Jander, Blasius: Einführung in das anorganisch-chemische Praktikum. 14. Auflage. S. Hirzel Verlag, Stuttgart, Leipzig 1995, ISBN 3-7776-0672-3.




