Silberdichromat
Silberdichromat ist eine anorganische chemische Verbindung des Silbers aus der Gruppe der Dichromate.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
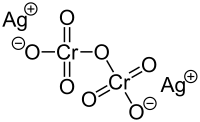 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Silberdichromat | |||||||||||||||
| Andere Namen |
Silberbichromat | |||||||||||||||
| Summenformel | Ag2Cr2O7 | |||||||||||||||
| Kurzbeschreibung |
dunkelroter Feststoff[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 431,72 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest[1] | |||||||||||||||
| Dichte |
4,77 g·cm−3[1] | |||||||||||||||
| Löslichkeit | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Gewinnung und Darstellung
Silberdichromat kann durch Reaktion von Silbernitrat mit Kaliumdichromat gewonnen werden.[4]
Diese Art der Synthese kann in Gel zur Bildung von Liesegangschen Ringen verwendet werden.[4]
Es sind auch noch Synthesen ausgehend von Silbersalicylat bekannt.[5][6]
Eigenschaften
Silberdichromat ist ein dunkelroter, nicht lichtempfindlicher[7] Feststoff, der praktisch unlöslich in Wasser ist.[1] Bei Erhitzung und in heißem Wasser zersetzt sich die Verbindung.[8]
Verwendung
Silberdichromat entsteht beim Nachweis von Silber durch Kaliumdichromat.[9] Es kann auch in Kopierpapieren eingesetzt werden.[7]
Einzelnachweise
- Dale L. Perry: Handbook of Inorganic Compounds, Second Edition. CRC Press, 2016, ISBN 978-1-4398-1462-8, S. 366 (eingeschränkte Vorschau in der Google-Buchsuche).
- Nicht explizit in Verordnung (EG) Nr. 1272/2008 (CLP) gelistet, fällt aber mit der angegebenen Kennzeichnung unter den Gruppeneintrag Chrom(VI)verbindungen, mit Ausnahme von Bariumchromat und Verbindungen die in diesem Anhang gesondert aufgeführt sind im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 11. Juni 2019. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Harmonisierte Einstufung und Kennzeichnung von Chrom(VI)verbindungen, mit Ausnahme von Bariumchromat und Verbindungen die in diesem Anhang gesondert aufgeführt sind im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 11. Juni 2019.
- Bartosz A. Grzybowski: Chemistry in Motion Reaction-Diffusion Systems for Micro- and Nanotechnology. John Wiley & Sons, 2009, ISBN 0-470-74163-5, S. 152 (eingeschränkte Vorschau in der Google-Buchsuche).
- F. Soofivand, F. Mohandes, M. Salavati-Niasari: Simple and facile synthesis of Ag2CrO4 and Ag2Cr2O7 micro/nanostructures using a silver precursor. In: Micro & Nano Letters. 7, 2012, S. 283, doi:10.1049/mnl.2012.0042.
- Faezeh Soofivand, Fatemeh Mohandes, Masoud Salavati-Niasari: Silver chromate and silver dichromate nanostructures: Sonochemical synthesis, characterization, and photocatalytic properties. In: Materials Research Bulletin. 48, 2013, S. 2084, doi:10.1016/j.materresbull.2013.02.025.
- Eduard Valenta: Photographische Chemie und Chemikalienkunde. BoD – Books on Demand, 2012, ISBN 978-3-86444-634-4, S. 155 (eingeschränkte Vorschau in der Google-Buchsuche).
- Christopher G. Morris, Academic Press: Academic Press Dictionary of Science and Technology. Gulf Professional Publishing, 1992, ISBN 0-12-200400-0, S. 1991 (eingeschränkte Vorschau in der Google-Buchsuche).
- Hans Bode: Elemente der Ersten Nebengruppe Kupfer · Silber · Gold. Springer-Verlag, 2013, ISBN 978-3-662-30624-6, S. 86 (eingeschränkte Vorschau in der Google-Buchsuche).
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. The authors of the article are listed here. Additional terms may apply for the media files, click on images to show image meta data.


