Scandiumsulfat
Scandiumsulfat ist eine anorganische chemische Verbindung des Scandiums aus der Gruppe der Sulfate.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
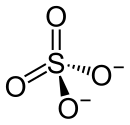 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Scandiumsulfat | |||||||||||||||
| Andere Namen |
Discandiumtrisulfat | |||||||||||||||
| Summenformel | Sc2(SO4)3 | |||||||||||||||
| Kurzbeschreibung |
farbloser Feststoff[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 468,18 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest[2] | |||||||||||||||
| Dichte |
2,579 g·cm−3[3] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Löslichkeit |
sehr gut löslich in Wasser[1] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Gewinnung und Darstellung
Scandiumsulfat kann durch Eindampfen einer mit Schwefelsäure versetzten Lösung von Scandiumnitrat und Erhitzen des Rückstands gewonnen werden.[4]
Eigenschaften
Scandiumsulfat ist ein farbloser kristaller Feststoff, der sehr gut löslich in Wasser ist.[1] Geringe Mengen an Schwefelsäure im Wasser setzen die Löslichkeit jedoch stark herab.[5] Er besitzt eine trigonale Kristallstruktur mit der Raumgruppe R3 (Raumgruppen-Nr. 148).[3] Die Verbindung liegt bei Raumtemperatur als Pentahydrat vor, der bei etwa 100 °C in das Dihydrat übergeht.[5] Es existiert auch ein Octahydrat.[6] Ab etwa 600 °C zersetzt sich die Verbindung und bis 850 °C bildet sich Scandiumoxid.[7]
Einzelnachweise
- Eintrag zu Scandium-Verbindungen. In: Römpp Online. Georg Thieme Verlag, abgerufen am 15. September 2015.
- Datenblatt Scandium(III) sulfate pentahydrate, 99.9% bei Sigma-Aldrich, abgerufen am 15. September 2015 (PDF).
- R. Blachnik: Taschenbuch für Chemiker und Physiker Band 3: Elemente, anorganische Verbindungen und Materialien, Minerale. Springer-Verlag, 2013, ISBN 978-3-642-58842-6, S. 718 (eingeschränkte Vorschau in der Google-Buchsuche).
- Albert Ladenburg: Handwörten der chemie. E. Trewendt, 1892, OCLC 19423544, S. 472 (eingeschränkte Vorschau in der Google-Buchsuche).
- F. Wirth: Über das Sulfat und Oxalat der Scandinerde. In: Zeitschrift für anorganische Chemie. 87, 1914, S. 9, doi:10.1002/zaac.19140870104.
- Dale L. Perry: Handbook of Inorganic Compounds, Second Edition. CRC Press, 2011, ISBN 978-1-4398-1462-8, S. 357 (eingeschränkte Vorschau in der Google-Buchsuche).
- C.T. Horovitz: Scandium Its Occurrence, Chemistry Physics, Metallurgy, Biology and Technology. Elsevier, 2012, ISBN 0-323-14451-9, S. 231 (eingeschränkte Vorschau in der Google-Buchsuche).
- John Emsley: Nature's Building Blocks An A-Z Guide to the Elements. Oxford University Press, 2001, ISBN 0-19-850340-7, S. 376 (eingeschränkte Vorschau in der Google-Buchsuche).