Samarium(III)-oxid
Samarium(III)-oxid ist eine chemische Verbindung aus der Gruppe der Oxide.
| Kristallstruktur | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
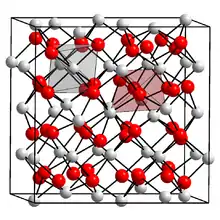 | ||||||||||||||||
| _ Sm3+ _ O2− | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Samarium(III)-oxid | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Verhältnisformel | Sm2O3 | |||||||||||||||
| Kurzbeschreibung |
geruchloser gelblicher Feststoff[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 348,72 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest[1] | |||||||||||||||
| Dichte |
8,347 g·cm−3[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Löslichkeit |
nahezu unlöslich in Wasser (20 °C)[1] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Geschichte
Samarium(III)-oxid wurde 1879 von Paul Émile Lecoq de Boisbaudran im Samarskit entdeckt.[2]
Gewinnung und Darstellung
Samarium(III)-oxid kann durch Verbrennung von Samarium an Luft gewonnen werden.
Es kann auch durch thermische Zersetzung von Samariumsalzen wie Samariumoxalat oder Samariumcarbonat bei Temperaturen um 700 °C gewonnen werden.[3]
Samarium(III)-oxid-Nanopartikel können durch Reaktion von Samariumhydrid mit Sauerstoff gewonnen werden.[4]
Insgesamt werden etwa 700 Tonnen pro Jahr hergestellt.[5]
Eigenschaften
_oxide.jpg.webp)
Samarium(III)-oxid ist ein geruchloser gelblicher Feststoff, der unlöslich in Wasser ist.[1] Er kommt in einer monoklinen und einer kubischen Kristallstruktur vor, wobei die kubische Form stabiler und häufiger ist.[4]
Verwendung
Samarium(III)-oxid wird in Infrarotstrahlung absorbierendem Glas verwendet. In der organischen Chemie katalysiert es die Reaktion von acyclischen primären Alkoholen zu Aldehyden und Ketonen. Eine weitere Anwendung ist die Herstellung von anderen Samariumsalzen,[6] wie Samarium(III)-sulfid.[7]
Einzelnachweise
- Datenblatt Samarium(III)-oxid (PDF) bei Merck, abgerufen am 8. März 2012.
- Mary Eagleson: Concise encyclopedia chemistry, S. 583 (eingeschränkte Vorschau in der Google-Buchsuche).
- Gerd Meyer, Lester R. Morss: Synthesis of lanthanide and actinide compounds. Springer Netherlands, 1990, ISBN 978-0-7923-1018-1, S. 196 (eingeschränkte Vorschau in der Google-Buchsuche).
- Eugene V. Dirote: Trends in nanotechnology research. 2004, ISBN 1-59454-091-8, S. 114 (eingeschränkte Vorschau in der Google-Buchsuche).
- John Emsley: Nature's building blocks: an A-Z guide to the elements. Oxford University Press, 2003, ISBN 0-19-850340-7, S. 372 (eingeschränkte Vorschau in der Google-Buchsuche).
- Pradyot Patnaik: Handbuch der Anorganischen Chemie. McGraw-Hill, 2002, ISBN 0-07-049439-8.
- G. Meyer, Lester R. Morss (Hrsg.): Synthesis of Lanthanide and Actinide Compounds. Springer, 1991, ISBN 0-7923-1018-7, S. 328 (eingeschränkte Vorschau in der Google-Buchsuche).