Rubidiumpentasulfid
Rubidiumpentasulfid ist eine chemische Verbindung aus Rubidium und Schwefel.
| Kristallstruktur | |||||||
|---|---|---|---|---|---|---|---|
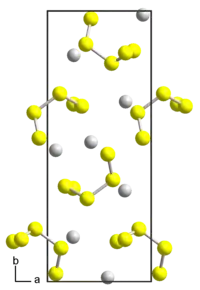 | |||||||
| _ Rb+ _ S2/5− | |||||||
| Allgemeines | |||||||
| Name | Rubidiumpentasulfid | ||||||
| Verhältnisformel | Rb2S5 | ||||||
| Kurzbeschreibung |
dunkelrote zerfließliche Kristalle[1] | ||||||
| Externe Identifikatoren/Datenbanken | |||||||
| |||||||
| Eigenschaften | |||||||
| Molare Masse | 331,24 g·mol−1 | ||||||
| Aggregatzustand |
fest | ||||||
| Dichte |
2,618 g·cm−3[1] | ||||||
| Schmelzpunkt | |||||||
| Löslichkeit |
schwerlöslich in Ethanol[1] | ||||||
| Sicherheitshinweise | |||||||
| |||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||
Herstellung
Rubidumpentasulfid kann aus Rubidiumsulfid und Schwefel in einer Wasserstoffatmosphäre hergestellt werden.[3][4]
Eigenschaften
Physikalische Eigenschaften
Rubidiumpentasulfid kristallisiert im orthorhombischen Kristallsystem in der Raumgruppe P212121 (Raumgruppen-Nr. 19) mit den Gitterparametern a = 683,7 pm, b = 1784,5 pm, c = 663,3 pm, und 4 Formeleinheiten pro Elementarzelle.[1]
Chemische Eigenschaften
Beim Erhitzen von Rubidiumpentasulfid im Stickstoffstrom entsteht unter Freisetzung von verdampftem Schwefel Rubidiumtrisulfid Rb2S3[5], das rotgelbe, stark hygroskopische Kristalle bildet und einen Schmelzpunkt von 213 °C hat.[3]
Beim Erhitzen im Wasserstoffstrom entsteht unter Entwicklung von Schwefelwasserstoff Rubidiumdisulfid[6][5], Rb2S2, dessen Schmelzpunkt bei 420 °C liegt, ebenfalls hygroskopisch ist und so wie das Trisulfid ein Monohydrat bildet.[3]
Einzelnachweise
- Jean D'Ans, Ellen Lax: Taschenbuch für Chemiker und Physiker. 3. Elemente, anorganische Verbindungen und Materialien, Minerale, Band 3. 4. Auflage, Springer, 1997, ISBN 978-3-5406-0035-0, S. 692 (eingeschränkte Vorschau in der Google-Buchsuche).
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- R. Abegg, F. Auerbach: 'Handbuch der anorganischen Chemie'. Verlag S. Hirzel, Bd. 2, 1908. S. 430.Volltext
- Wilhelm Biltz, Ernst Wilke-Dörfurt: "Ueber die Pentasulfide des Rubidiums und Cäsiums" in Ber. d. dt. chem. Ges. 1905, 38(1), S. 123–130. doi:10.1002/cber.19050380114
- Wilhelm Biltz, Ernst Wilke-Dörfurt: "Die Sulfide des Rubidiums und Cäsiums", in Zeitschr. f. anorg. Chem. 1906, 50(1), S. 67–81. Volltext
- Wilhelm Biltz, Ernst Wilke-Dörfurt: "Über Sulfide des Rubidiums und Cäsiums" in Zeitschr. f. anorg. Chem. 1906. 48, S. 297–317. Volltext