Rubidiumbromat
Rubidiumbromat ist das Rubidiumsalz der Bromsäure mit der chemischen Zusammensetzung RbBrO3.
| Strukturformel | |||||||
|---|---|---|---|---|---|---|---|
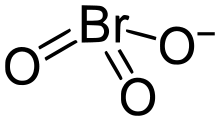 | |||||||
| Allgemeines | |||||||
| Name | Rubidiumbromat | ||||||
| Summenformel | RbBrO3 | ||||||
| Externe Identifikatoren/Datenbanken | |||||||
| |||||||
| Eigenschaften | |||||||
| Molare Masse | 213,37 g·mol−1 | ||||||
| Aggregatzustand |
fest | ||||||
| Dichte |
3,68 g·cm−3[1] | ||||||
| Schmelzpunkt | |||||||
| Löslichkeit |
29,3 g·l−1 bei 25 °C[1] | ||||||
| Sicherheitshinweise | |||||||
| |||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||
Herstellung
Rubidiumbromat kann aus Rubidiumcarbonat und Bromsäure hergestellt werden.[3]
Auch die Herstellung aus Rubidiumcarbonat und Natriumbromat ist möglich.[4]
Eigenschaften
| Löslichkeit von RbBrO3 in Wasser[5] | ||||
| Temperatur [°C] | 25 | 30 | 35 | 40 |
| Löslichkeit [g/l] | 29,3 | 35,5 | 42,8 | 50,8 |
Die Löslichkeit von Rubidiumbromat in Wasser ist in nebenstehender Tabelle angegeben.
Rubidiumbromat kristallisiert ohne Kristallwasser[6] im trigonalen Kristallsystem mit der Raumgruppe R3m (Raumgruppen-Nr. 160) und den Gitterparametern a = 621.8 pm und c = 809.9 pm, in der Elementarzelle befinden sich drei Formeleinheiten.[7] Rubidiumbromat reagiert mit Bromwasserstoff unter Bildung von Rubidiumtribromid.[8]
Einzelnachweise
- Dale L. Perry, Sidney L. Phillips: Handbook of inorganic compounds. CRC Press, 1995, ISBN 978-0-8493-8671-8, S. 333 (eingeschränkte Vorschau in der Google-Buchsuche).
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- Harold D. Buell, C. R. McCrosky: "The preparation and study of the rarer alkali bromates. Rubidium bromate." in J. Am. Chem. Soc 1921, 43(9), S. 2031–2034. doi:10.1021/ja01442a006
- Vernon A. Stenger, Richard M. Van Effen: "Solubilities of Alkali Metal Bromates and Iodates in Methanol at Room Temperature" in J. Chem. Eng. Data 1999, 44(2), S. 173–174. doi:10.1021/je980120a
- Aterton Seidell: "Solubilities Of Organic Compounds Vol - I", S. 1429. Volltext
- J. W. Mellor: "A comprehensive treatise on inorganic and theoretical chemistry", Band 2, Verlag Longmans, Green 1965. S. 763, (eingeschränkte Vorschau in der Google-Buchsuche)
- Jean D'Ans, Ellen Lax: Taschenbuch für Chemiker und Physiker. 3. Elemente, anorganische Verbindungen und Materialien, Minerale, Band 3. 4. Auflage, Springer, 1997, ISBN 978-3-5406-0035-0, S. 684 (eingeschränkte Vorschau in der Google-Buchsuche).
- John E. Lind jr., Raymond M. Fuoss: "Conductance of the Alkali Halides. IV. Rubidium Bromide in Dioxane-Water mixtures" in J. Phys. Chem. 1962, 66 (9), S. 1727–1729. doi:10.1021/j100815a041
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. The authors of the article are listed here. Additional terms may apply for the media files, click on images to show image meta data.