Rosenoxid
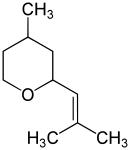
Rosenoxid ist eine chemische Verbindung aus der Gruppe der Pyrane und monozyklischen Monoterpene, die als einer der Hauptgeruchsstoffe in Rosen und Rosenöl enthalten ist.[6] Rosenoxid ist chemisch gesehen ein Stoffgemisch aus mehreren isomeren Formen.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||
| Vereinfachte Strukturformel ohne Stereochemie | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Rosenoxid | ||||||||||||||||||
| Andere Namen | |||||||||||||||||||
| Summenformel | C10H18O | ||||||||||||||||||
| Kurzbeschreibung |
farblose Flüssigkeit[2] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 154,25 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig | ||||||||||||||||||
| Dichte |
0,866 g·cm−3[4] | ||||||||||||||||||
| Siedepunkt | |||||||||||||||||||
| Löslichkeit |
schwach löslich in Wasser[5] | ||||||||||||||||||
| Brechungsindex |
1,452[4] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Vorkommen
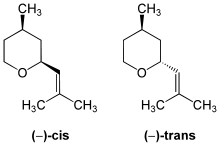
Bei Rosenoxid handelt es sich um ein Stoffgemisch aus den isomeren cis- und trans-Formen der Verbindung, wobei natürlich meist die (linksdrehende) cis-Form vorliegt und nur (−)-cis-Rosenoxid den typischen Rosengeruch verbreitet. Sie ist neben anderen Verbindungen für den charakteristischen Duft von Rosenöl und Geraniumöl verantwortlich.

Natürlich kommt Rosenoxid neben in Rosen auch in einigen Weinsorten und in Lindenblüten (und damit auch in Lindenhonig) vor und ist mit für den Geruch und Geschmack verantwortlich.[7][8] Darüber hinaus kommt (−)-cis-Rosenoxid in ätherischen Ölen, beispielsweise im Geraniumöl oder im bulgarischen Rosenöl vor.
Auch im Abwehrsekret einiger Arten der Bockkäfer kommt Rosenoxid vor.[6]
Gewinnung und Darstellung
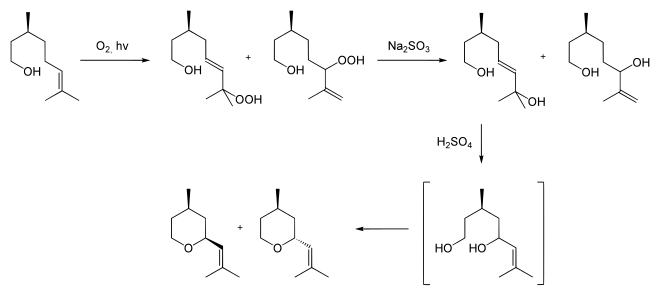
Großtechnisch kann Rosenoxid über die solare Photooxidation von Citronellol oder aus Halohydrinen oder Epoxiden gewonnen werden.[9][10] Bei der häufigeren Synthese ausgehend von Citronellol wird dieses durch Einleiten von Sauerstoff mit UV-Licht in Allylhydroperoxide überführt. Diese werden mittels Natriumsulfit in Diole reduziert. Nur das aus dem tertiären Allylhydroperoxid gebildete Diol lässt sich dann mittels verdünnter Schwefelsäure cyclisieren.[3] Dabei entstehen (−)-cis bzw. (−)-trans-Rosenoxid zu gleicher Ausbeute.
Die mikrobielle Gewinnung von Rosenoxid ist ebenfalls möglich.[11]
Eigenschaften
Rosenoxid verfärbt sich nicht und ist relativ stabil.[3]
Verwendung
Rosenoxid wird wegen seiner starken Geraniumspitzennote in der Parfümindustrie eingesetzt, häufig bei Seifen, Kosmetika und anderen Haushaltsprodukten.
Einzelnachweise
- Eintrag zu ISOBUTENYL METHYLTETRAHYDROPYRAN in der CosIng-Datenbank der EU-Kommission, abgerufen am 18. September 2021.
- Rose Oxide 70. CAS-No. 16409-43-1. BASF, abgerufen am 5. Mai 2017.
- Dieter Martinetz und Roland Hartwig: Taschenlehrbuch der Riechstoffe: ein Lexikon von A–Z. Verlag Harri Deutsch 1998; ISBN 3-8171-1539-3; S. 330ff.
- Datenblatt Tetrahydro-4-methyl-2-(2-methyl-1-propenyl)-2H-pyran, ≥98%, mixture of cis and trans bei Sigma-Aldrich, abgerufen am 5. Mai 2017 (PDF).
- Tetrahydro-4-methyl-2-(2-methylpropen-1-yl)pyran. FAO, abgerufen am 5. Mai 2017.
- Eintrag zu Rosenoxid. In: Römpp Online. Georg Thieme Verlag, abgerufen am 5. Mai 2017.
- Matthias Wüst: Wein – Qualität entscheidet sich in Nanogramm: Zur Biochemie des sortentypischen Weinaromas. In: Chemie in unserer Zeit. 37, S. 8–17, Januar 2003, doi:10.1002/ciuz.200390020.
- 1.4. Primäre Aromastoffe von Lindenhonig im Vergleich zu Honigen anderer Herkunft. DFAL, 1989, archiviert vom Original am 16. Mai 2004; abgerufen am 5. Mai 2017.
- Patent WO2001017983: Method for producing rose oxide using halohydrins or epoxides. Veröffentlicht am 15. März 2001, Erfinder: Martin Demuth, Xuechao Xing, Kurt Schaffner.
- Birgit Witte: Photochemische und thermische Anellierungsreaktionen von konjugierten Alkinylcyclohex-2-enonen. Hamburg 1999, DNB 95869883X, urn:nbn:de:gbv:18-1223 (Dissertation, Universität Hamburg).
- Georg Schwedt: Betörende Düfte, sinnliche Aromen. Wiley-VCH, Weinheim 2012, ISBN 978-3-527-32045-5 (eingeschränkte Vorschau in der Google-Buchsuche).