Ricinin
Ricinin ist ein giftiger Inhaltsstoff aus dem Rizinusbaum (Ricinus communis),[4] es gehört zur Gruppe der Pyridin-Alkaloide und ist neben dem hochgiftigen Polypeptid Ricin verantwortlich für die Giftigkeit der Pflanze. Ricinin kommt in allen Teilen der Pflanze vor und hat unter anderem insektizide Wirkung. Beim Menschen greift es die Leber und Nieren an und kann tödliche Vergiftungen verursachen. Die Samen enthalten etwa 0,2 % des Alkaloids.[5] Im Gegensatz zu Ricin lässt sich Ricinin nicht durch Hitzebehandlung neutralisieren. Um daher Presskuchen der Rizinuskerne als Tierfutter zu verwerten, muss Ricinin nach Zerstörung des Ricins durch aufwändige Extraktion entfernt werden, siehe auch Rizinusöl.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
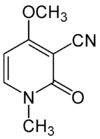 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Ricinin | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C8H8N2O2 | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 164,16 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Löslichkeit | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Synthetisch ist Ricinin durch Cyclisierung von 1,1-Dicyano-4-(N,N-dimethylamino)-2-methoxy-1,3-butadien und nachfolgender Methylierung herstellbar. In der Pflanze wird es über Nicotinamid als Zwischenstufe biosynthetisch erzeugt.
Gewinnung aus der Pflanze
Wie die meisten Alkaloide lässt sich auch Ricinin leicht aus dem pflanzlichen Material isolieren. Nach Extraktion der frischen zerstampften Sämlinge aus den Rizinussamen mit Chloroform und Waschen der Chloroformphase mit Ammoniaklösung erhält man nach Eindampfen einen Rückstand mit hohem Gehalt an Ricinin. Nach Entfernen der Fette und Lipide mittels Diethylether wird reines Ricinin durch wiederholtes Auflösen und Umkristallisieren aus Chloroform gewonnen.
Analytik
Der zuverlässige Nachweis und die Quantifizierung von Ricinin gelingt durch die GC/MS-Analytik nach adäquater Probenvorbereitung der zu untersuchenden Matrices.[6]
Literatur
- M. Mittelbach, G. Kastner, H. Junek; Ricinin – einfach synthetisiert. In: Monatshefte für Chemie. 115(12), S. 1467–1470, 1984, doi:10.1007/BF00816346.
- Eintrag zu Ricinin. In: Römpp Online. Georg Thieme Verlag, abgerufen am 6. Oktober 2014.
- G. R. Waller, L. M. Henderson: Biosynthesis of the Pyridine Ring of Ricinine. In: J. Bio. Chem. 236(4), 1961, PMID 13782834, Volltext (PDF; englisch).
Weblinks
- Ernst Späth, Georg Koller: Die Synthese des Ricinins. In: Berichte der deutschen chemischen Gesellschaft (A and B Series). 1923, Volume 56, Issue 11, S. 2454–2460, doi:10.1002/cber.19230561125.
Einzelnachweise
- Eintrag zu Ricinin. In: Römpp Online. Georg Thieme Verlag, abgerufen am 6. Oktober 2014.
- Eintrag zu Ricinine in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM), abgerufen am 25. März 2021.
- Für diesen Stoff liegt noch keine harmonisierte Einstufung vor. Wiedergegeben ist eine von einer Selbsteinstufung durch Inverkehrbringer abgeleitete Kennzeichnung von Ricinine im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 15. März 2019.
- Karl Paech: Biochemie und Physiologie der Sekundären Pflanzenstoffe. Springer, 1950, ISBN 978-3-662-27790-4 (Reprint), S. 222.
- Marco Soave: Über Ricinin. In: Chemisches Zentralblatt. Vol. 66, Bd. I, 1895, S. 853, Textarchiv – Internet Archive.
- H. U. Melchert, E. Pabel: Reliable identification of trichothecenes and other mycotoxins by electron impact and chemical ionization-gas chromatography-mass spectrometry, using an ion-trap system in the multiple mass spectrometry mode. Candidate reference method for complex matrices. In: J. Chromatogr. A., 12, 1056(1-2), 2004, S. 195–199, PMID 15595550.
