Cytochrom-b6f-Komplex
Der Cytochrom-b6f-Komplex (auch Plastochinol-Plastocyanin-Oxidoreduktase) ist ein Proteinkomplex, der in die Thylakoidmembran von Pflanzen, Algen und Cyanobakterien eingebettet ist. Neben dem Photosystem II und dem Photosystem I ist er einer der zentralen Proteinkomplexe der oxygenen Photosynthese. Er hat die Aufgabe, Elektronen von membrangebundenem Plastochinon auf lösliches Plastocyanin bzw. Cytochrom c6 zu übertragen und Protonen vom Stroma ins Lumen zu „pumpen“. Seine Funktion ähnelt somit dem Cytochrom-bc1-Komplex.
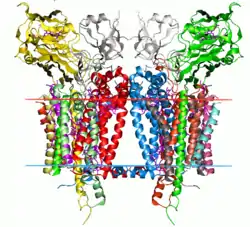
Struktur
Der funktionale Komplex ist ein Homo-Dimer von etwa 220 kDa, dessen zwei Monomere aus jeweils neun Untereinheiten aufgebaut sind. In Pflanzen sind die drei Untereinheiten PetC, PetM, Ferredoxin-NADP+-Reduktase/petH auf dem Kerngenom und die sechs Untereinheiten PetA, PetB, PetD, PetN, PetG und PetL auf dem Plastidengenom codiert.[1] Das Monomer enthält sieben Kofaktoren: Ein Chlorophyll-a-Molekül, ein β-Carotin, ein Eisen-Schwefel-Cluster, das Häm des Cytochrom f, und die drei Hämgruppen des Cytochrom b6 (Häm bn, bp und x).
PetC, nach seinem Entdecker John S. Rieske auch Rieske-Protein genannt,[2] zählt zu den kerncodierten Untereinheiten und enthält einen 2-Eisen-2-Schwefel-Cluster. Es ist wichtig für die Stabilität des Dimers, da dessen transmembrane Helix mit der Helix des jeweils anderen Monomers interagiert.[3][4] Die Rolle der kerncodierten Untereinheit PetM ist bislang nicht bekannt. Die dritte kerncodierte Untereinheit ist die Ferredoxin-NADP+-Reduktase (FNR, codiert durch das Gen petH), die auf der Stromaseite des Komplexes lokalisiert ist.
Die drei plastomcodierten Untereinheiten PetA (Cytochrom f), PetB (Cytochrom b6), PetD (Untereinheit IV) sind zusammen mit dem Rieske-Protein am linearen Elektronentransport beteiligt und essentiell für Zusammenbau, Stabilität und Funktion des Komplexes. Cytochrom f enthält ein Cytochrom des c-Typs, das Häm wird also kovalent über Thioetherbindungen von zwei Cysteinresten gebunden. Die b6-Untereinheit des Komplexes enthält zwei Cytochrome des b-Typs, die nach ihrer relativen Orientierung zum elektronegativen Lumen bzw. elektropositiven Stroma Cytochrom bn und Cytochrom bp (auch entsprechend ihrem Redoxpotential Cytochrom bL von engl. low und bH von high) genannt werden. Die beiden Häme werden durch zwei Histidine nicht-kovalent gebunden. Die Bindung erfolgt wahrscheinlich spontan.[5] Die Funktion des dritten Häms ("Häm x" oder "Häm cn") ist unbekannt.
Die drei kleinen plastomcodierten Untereinheiten PetN, PetG und PetL sind an der Peripherie des Komplexes lokalisiert und vermutlich an einer Interaktion mit den anderen Photosynthesekomplexen beteiligt. PetN und PetG scheinen essentiell zu sein, da ihr Ausschalten in Chlamydomonas und Tabak zum Verlust des Komplexes führt.[6][7][8] In höheren Pflanzen existiert somit nur eine einzige nicht-essentielle Untereinheit, nämlich PetL.[9] In Chlamydomonas dagegen führt ein Ausschalten von PetL zu einer Destabilisierung des Komplexes, wodurch der Komplexgehalt stark vermindert wird.[10] Das Cyanobakterium Synechocystis besitzt derweil einen funktionalen Cytochrom-b6-Komplex ohne PetL.[11]
Funktion
Die Lichtreaktion der Photosynthese ist eine Abfolge von Elektronenübergängen, die bei Pflanzen in den Thylakoiden der grünen Chloroplasten stattfindet. Während des linearen Elektronentransports gewinnt Photosystem II unter der Nutzung von Lichtenergie Elektronen aus Wasser. Die Elektronen werden zunächst auf das membrangebundene Molekül Plastochinon (PQH2), und dann über den Cytochrom-b6f-Komplex auf Plastocyanin (PC) und schließlich über das Photosystem I auf NADP+ übertragen. Der Komplex nimmt eine zentrale Rolle in der Elektronentransportkette der oxygenen Photosynthese ein, da die Oxidation von Plastochinol der langsamste und somit ratenlimitierende Schritt des linearen Elektronentransports ist.
Durch Photosystem II reduziertes PQH2 diffundiert in der Thylakoidmembran zum QO-Zentrum des Cytochrom-b6f-Komplexes. Dieser vermittelt zwei aufeinanderfolgende Elektronenübergänge. Das erste Elektron wird PQH2 durch das Rieske-Protein, ein 2-Eisen-2-Schwefel-Protein, entzogen. Dadurch entsteht ein Semichinon-Radikal PQH•−. Die Cytochrome bn und bp der b-Untereinheit übertragen das zweite Elektron vom PQH•− auf ein oxidiertes Plastochinon (PQ), welches dann durch H+ aus dem Stroma protoniert wird und somit maßgeblich zum Aufbau der thylakoidalen Protonengradienten beiträgt (Q-Zyklus[5][12]). Die PQH2-Oxidation ist mit einer Dauer von etwa 5 ms relativ langsam und so der ratenlimitierende Schritt der Elektronentransportkette.[13][5][14] Begründet ist dies wahrscheinlich in der notwendigen Konformationsänderung des Rieske-Proteins und der eingeschränkten Diffusion des PQH2 zum QO-Zentrum des Komplexes, das sich in einer tief eingesenkten Tasche befindet.[5]
Das Elektron wird vom Rieske-Protein über die Cytochrom-f-Untereinheit direkt auf das luminale, lösliche Protein Plastocyanin übertragen. In einigen Algen und Cyanobakterien geschieht die Übertragung mitunter auf den alternativen, löslichen Elektronenträger Cytochrom c6.
In Summa wird PQH2 zu PQ reoxidiert, ein Elektron wird im Q-Zyklus wiederverwendet und ein Elektron wird schließlich auf Plastocyanin, das jeweils ein Elektron aufnehmen kann, übertragen. Bei dieser Weitergabe wird außerdem pro Elektron ein Proton aus dem Stroma der Chloroplasten in das Thylakoidlumen transloziert.
Einzelnachweise
- Whitelegge, J.P., et al. (2002): Full subunit coverage liquid chromatography electrospray ionization mass spectrometry (LCMS+) of an oligomeric membrane protein: cytochrome b(6)f complex from spinach and the cyanobacterium Mastigocladus laminosus. In: Mol Cell Proteomics 1(10): S. 816–827; PMID 12438564
- Rieske, JS., Maclennan, DH. und Coleman, R. (1964): Isolation and properties of an iron-protein from the (reduced coenzyme Q)-cytochrome C reductase complex of the respiratory chain. In: Biochemical and Biophysical Research Communications 15(4); 338–344; doi:10.1016/0006-291X(64)90171-8
- Hauska, G., Schütz, M., Büttner, M. (1996): The Cytochrome b6f Complex – Composition, Structure and Function. In: Oxygenic Photosynthesis: The Light Reaction, ed. O.D.R.a.Y. C.F., Kluwer Academic Publisher.
- Maiwald, D., et al. (2003): Knock-out of the genes coding for the Rieske protein and the ATP- synthase delta-subunit of Arabidopsis. Effects on photosynthesis, thylakoid protein composition, and nuclear chloroplast gene expression. In: Plant Physiol 133(1); S. 191–202; PMID 12970486
- Baniulis et al. (2008): Structure-function of the cytochrome b6f complex. In: Photochem Photobiol 84 (6) pp. 1349–1358, PMID 19067956
- Hager, M., et al. (1999): Targeted inactivation of the smallest plastid genome-encoded open reading frame reveals a novel and essential subunit of the cytochrome b(6)f complex. In: Embo J, 18(21); S. 5834–5842; PMID 10545095
- Berthold, D.A., C.L. Schmidt, und R. Malkin (1995): The deletion of petG in Chlamydomonas reinhardtii disrupts the cytochrome bf complex. In: J Biol Chem, 270(49); S. 29293–29298; PMID 7493961
- Schwenkert, S., et al. (2007): Role of the low-molecular-weight subunits PetL, PetG, and PetN in assembly, stability, and dimerization of the cytochrome b6f complex in tobacco. In: Plant Physiol 144(4); S. 1924–1935; PMID 17556510
- Fiebig, A., S. Stegemann, and R. Bock (2004): Rapid evolution of RNA editing sites in a small non-essential plastid gene. In: Nucleic Acids Research 32(12); S. 3615–3622; PMID 15240834
- Takahashi, Y., et al.(1996): The chloroplast ycf7 (petL) open reading frame of Chlamydomonas reinhardtii encodes a small functionally important subunit of the cytochrome b6f complex. In: Embo J 15(14); S. 3498–3506; PMID 8670852
- Kaneko, T., et al. (1996): Sequence analysis of the genome of the unicellular cyanobacterium Synechocystis sp. strain PCC6803. II. Sequence determination of the entire genome and assignment of potential protein-coding regions. In: DNA Res 3(3); S. 109–136; PMID 8905231
- Mitchell (1975): Protonmotive redox mechanism of Cytochrome-b-c1 complex in respiratory-chain – protonmotive ubiquinone cycle. In: FEBS Lett 56 (1); 1–6; PMID 239860
- Haehnel (1984): Photosynthetic Electron Transport in Higher Plants. In: Annu Rev Plant Biol 35; 659–693; doi:10.1146/annurev.pp.35.060184.003303
- Hope (2000): Electron transfers amongst cytochrome f, plastocyanin and photosystem I: kinetics and mechanisms. In: Biochim Biophys Acta 1456 (1) pp. 5–26; PMID 10611452