Pseudoisocytidin
Pseudoisocytidin ist ein synthetisches Nukleosid. Es besteht aus dem Zucker β-D-Ribofuranose und der Nukleinbase Isocytosin. Pseudoisocytidin ist ein Isomer des Cytidins. Andere Isomere sind Isocytidin und Pseudocytidin.
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
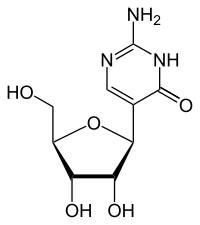 | |||||||||||||
| Pseudoisocytidin (3H-Tautomer) | |||||||||||||
| Allgemeines | |||||||||||||
| Name | Pseudoisocytidin | ||||||||||||
| Andere Namen |
| ||||||||||||
| Summenformel | C9H13N3O5 | ||||||||||||
| Kurzbeschreibung |
weißer Feststoff[1] | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 243,22 g·mol−1 | ||||||||||||
| Aggregatzustand |
fest[1] | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||
Eigenschaften
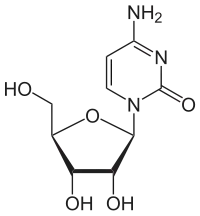
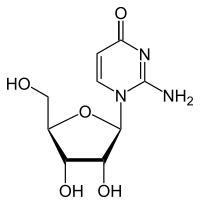
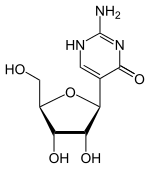
Chemisch handelt es sich um ein C-Glycosid, bei dem die β-D-Ribose mit dem C5-Atom der Base Isocytosin verknüpft ist. Im Cytidin und Isocytidin dagegen ist die Ribose mit einem N-Atom verknüpft. Diese Art der Verknüpfung zwischen Ribose und Base ähnelt der im Pseudouridin. Durch die Isomerie vom Cytidin zum Isocytidin tauschen Aminogruppe und Carbonylgruppe die Plätze. Durch die Isomerie zum Pseudocytidin erfolgt ein erneuter Tausch, so dass man das Substitutionsmuster des Cytidins wieder vorfindet.
 |
 |
 |
 |
| Cytidin, C | Isocytidin, iC | Pseudoisocytidin, psiC (1H-Tautomer) |
Pseudoisocytidin, psiC (3H-Tautomer) |
Pseudoisocytidin kommt in zwei Tautomeren vor, das Proton sitzt entweder am N1- oder am N3-Stickstoff.[3]
Pseudoisocytidin erwies sich bei einem pH-Wert von 7,4 für mindestens 6 Tage bei 22 °C und mindestens 3 Tage bei 37 °C als chemisch stabil, wobei keine Anzeichen für eine Epimerisierung festgestellt wurden.[4]
Verwendung
Pseudoisocytidin wird als stabileres Analogon von 5-Azacytidin angesehen, vor allem gegen verschiedene 1-β-D-Arabinofuranosylcytosin-resistente Stämme von Leukämie in Mäusen.[5]
Einzelnachweise
- Biosynth Carbosynth: Pseudoisocytidine | 57100-18-2 | Biosynth Carbosynth, abgerufen am 23. Januar 2022
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- Lou-Sing Kana, W-C. Lina, R. Dayal Yadava, J. H. Shiha & Ito Chaoa: „NMR Studies of the Tautomerism in Pseudoisocytidine“, Nucleosides and Nucleotides, 1999, 18 (4–5), S. 1091–1093 (doi:10.1080/15257779908041655).
- Robert Harmon: Chemistry and Biology of Nucleosides and Nucleotides. Academic Press, 2012, ISBN 978-0-323-14827-6, S. 461 (books.google.com).
- J. H. Burchenal, K. Ciovacco, K. Kalaher, T. O'Toole, R. Kiefner, M. D. Dowling, C. K. Chu, K. A. Watanabe, I. Wempen, J. J. Fox: „Antileukemic Effects of Pseudoisocytidine, a New Synthetic Pyrimidine C-Nucleoside“, Cancer Research, 1976, 36 (4), S. 1520–1523 (PMID 1260769; PDF).