Perampanel
Perampanel (INN, Handelsname Fycompa) ist ein Wirkstoff zur Behandlung von Epilepsien (Antikonvulsivum) und als solcher für die Zusatztherapie fokaler Anfälle mit oder ohne sekundäre Generalisierung bei Epilepsiepatienten ab zwölf Jahren zugelassen. Die Zulassung durch die EU-Kommission erfolgte im Juli 2012.[3] Perampanel unterliegt der Verschreibungspflicht.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
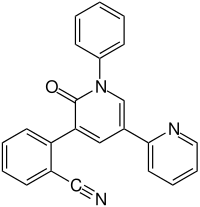 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Perampanel | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C23H15N3O | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code |
N03AX22 | |||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 349,38 g·mol−1 | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Wirkmechanismus
Perampanel ist ein selektiver, nicht-kompetitiver Antagonist an AMPA-Rezeptoren und führt zu einer gezielten Blockade dieser Rezeptoren an Nervenzellen: AMPA-Rezeptoren vermitteln hier die Wirkung des erregenden Botenstoffes Glutamat. Da im epileptischen Anfallsgeschehen ein Missverhältnis zwischen erregenden und hemmenden Signalen (zugunsten der Erregung) besteht, wird durch die Blockade der AMPA-Rezeptoren eine Unterdrückung der epileptischen Anfälle bzw. ihrer Ausbreitung im Gehirn angestrebt. Perampanel ist der erste zugelassene Wirkstoff, der an AMPA-Rezeptoren gezielt angreift.
Wirksamkeit und Verträglichkeit in klinischen Studien
Im Rahmen klinischer Studien, die die Wirksamkeit und Verträglichkeit von Perampanel in Dosierungen von bis zu 12 mg untersuchten, wurde eine (statistisch abgesicherte) Verminderung der Häufigkeit epileptischer Anfälle ab einer Dosis von 4 mg beobachtet.[4][5][6] Verglichen wurde hierbei mit Studienteilnehmern, die ein Scheinmedikament ohne Wirksubstanz (Placebo) erhielten. Die in den Studien am häufigsten beobachteten Nebenwirkungen waren Schwindel und Schläfrigkeit (bei jeweils mehr als 10 % der Studienteilnehmer). Andere Nebenwirkungen traten mit geringeren Häufigkeiten auf. Voraussetzung für eine Teilnahme an diesen Studien war das Auftreten fokaler Anfälle mit oder ohne sekundäre Generalisierung trotz aktueller Behandlung mit bis zu drei (anderen) Antikonvulsiva.
Eine seltene, aber forensisch wichtige Nebenwirkung, stellen „Aggressionen und feindseliges Verhalten“ dar, die in Einzelfällen bis zu „Angriffen gegen andere Personen“ führen können.[7]
Anwendung
Perampanel ist bis zu einer Höchstdosis von 12 mg zugelassen. Die Aufdosierung zum individuellen Optimum aus Wirksamkeit und Verträglichkeit erfolgt in Dosisschritten von 2 mg (je nach Zusatzmedikation in wöchentlichen oder zweiwöchentlichen Intervallen). Die Tablette wird einmal täglich vor dem Schlafengehen eingenommen.
Frühe Nutzenbewertung (AMNOG)
Seit 2011 müssen sich neu zugelassene Medikamente mit neuen Wirkstoffen in Deutschland aufgrund § 35a SGB V (AMNOG) einer „frühen Nutzenbewertung“ durch den Gemeinsamen Bundesausschuss (G-BA) unterziehen, wenn der pharmazeutische Hersteller einen höheren Verkaufspreis als nur den Festbetrag erzielen möchte. Nur wenn ein Zusatznutzen besteht, kann der Arzneimittelhersteller mit dem Spitzenverband der gesetzlichen Krankenkassen (GKV Spitzenverband) einen höheren Preis als Festbetrag aushandeln. Dies gilt auch für Perampanel. Das Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG) hat 2012 – im Auftrag des G-BA – gemäß AMNOG überprüft, ob Perampanel gegenüber der bisherigen Standardtherapie einen Zusatznutzen bietet. Aus dem Dossier ließ sich ein solcher Zusatznutzen für das IQWiG nicht ableiten, da der Hersteller darin keine relevanten Daten für den Vergleich mit den Wirkstoffen Lamotrigin oder Topiramat vorgelegt hat.[8] In einer Stellungnahme halten die Deutsche Gesellschaft für Epileptologie und die Deutsche Gesellschaft für Neurologie die geforderte Vergleichsmethodik allerdings nicht für sinnvoll.[9] Der G-BA hat auf Basis der IQWiG-Beurteilung am 7. März 2013 beschlossen, dass ein Zusatznutzen im Verhältnis zur zweckmäßigen Vergleichstherapie nicht belegt sei.[10]
Daraufhin hat Eisai im Juni 2013 entschieden, das Arzneimittel – aus Gründen der Wirtschaftlichkeit – in Deutschland nicht mehr anzubieten.[11] Die Versorgung der Epilepsie-Patienten, die bisher mit Perampanel behandelt wurden, wurde trotz dieses Rückzuges weiterhin – seitens des Unternehmens – sichergestellt.[12]
Bei einer zweiten Bewertung durch das IQWiG wurde ebenfalls kein Zusatznutzen attestiert, worauf Eisai das IQWiG kritisierte.[13][14] Mit dem Beschluss des G-BA vom 6. November 2014 wurden die Angaben zu Perampanel in der Fassung des Beschlusses vom 7. März 2013 BAnz AT 26.03.2013 B4 zwar wieder aufgehoben. Aber es blieb bei der (neuen) Einschätzung des G-BA, dass weiterhin kein Zusatznutzen bestehe.[15] Eisai hat weiterhin bekräftigt, dass die Patientenversorgung für die – bisher eingestellten – Patienten gesichert sei.[16] Dabei wurde Patienten ein Einzelimport aus der Schweiz angeboten, welchen die Clinigen Group PLC abwickelte. Bemängelt wurde, dass es sich für Apotheken um ein komplexes und zunächst datenschutzrechtliches umstrittenes Prozedere handele.[17]
Im April 2016 wurde das Prozedere eingestellt. Damit konnte das europaweit zugelassene Medikament nur noch über einen Einzelimport (nach § 73 Abs. 3 Nr. 1 AMG) bezogen werden. Diese Möglichkeit besteht nur, wenn das Medikament in Deutschland oder einem anderen EU-Land zugelassen ist, jedoch nicht zur Verfügung steht. Gründe für eine Nichtverfügbarkeit können eine Marktrücknahme oder ein Lieferengpass sein.[17] Eisai beklagte nach wie vor, dass der G-BA den Zusatznutzen nur aus methodischen Gründen nicht anerkannt habe und „nachgewiesenen klinischen Patientennutzen nicht angemessen bewertet“ habe.[17] Damit Patienten das Medikament nicht privat bezahlen mussten, konnte bei der Krankenkasse ein Antrag auf Kostenübernahme gestellt werden.[17]
Seit 1. Dezember 2017 ist Fycompa per Kassenrezept auf dem deutschen Markt erhältlich, denn Hersteller Eisai und der GKV-Spitzenverband haben sich auf einen Erstattungspreis geeinigt.[18]
Weblinks
- Öffentlicher Beurteilungsbericht (EPAR) der europäischen Arzneimittelagentur (EMA) zu: Perampanel
Einzelnachweise
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- Clearsynth: E-2007 (Memento vom 7. April 2014 im Internet Archive) (PDF; 579 kB)
- European Medicines Agency – EPAR summary for the public (Perampanel) (PDF; 124 kB).
- J. A. French, G. L. Krauss, V. Biton, D. Squillacote, H. Yang, A. Laurenza, D. Kumar, M. A. Rogawski: Adjunctive perampanel for refractory partial-onset seizures: randomized phase III study 304. In: Neurology. Band 79, Nr. 6, 7. Aug 2012, S. 589–596.
- J. A. French, G. L. Krauss, B. J. Steinhoff, D. Squillacote, H. Yang, D. Kumar, A. Laurenza: Evaluation of adjunctive perampanel in patients with refractory partial-onset seizures: Results of randomized global phase III study 305. In: Epilepsia. 20. Aug 2012. doi:10.1111/j.1528-1167.2012.03638.x.
- G. L. Krauss, J. M. Serratosa, V. Villanueva, M. Endziniene, Z. Hong, J. French, H. Yang, D. Squillacote, H. B. Edwards, J. Zhu, A. Laurenza: Randomized phase III study 306: adjunctive perampanel for refractory partial-onset seizures. In: Neurology. Band 78, Nr. 18, 1. Mai 2012, S. 1408–1415.
- Frau bekommt Medikament, das aggressiv macht. ORF, 27. November 2017, abgerufen am 27. November 2017.
- Perampanel bei Epilepsie: Keine Belege für Zusatznutzen. Pressemitteilung des IQWiG vom 17. Dezember 2012.
- Stellungnahmezu Perampanel April 2013.
- Tragende Gründe zum Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII – Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach § 35a SGB V – Perampanel (PDF; 87 kB). Gemeinsamer Bundesausschuss, 7. März 2013.
- Eisai stoppt Vermarktung von Fycompa. Meldung in der Ärzte Zeitung vom 26. Juni 2013.
- Patientenversorgung trotz Rückzug des Unternehmens gesichert. Pressemitteilung Gemeinsamer Bundesausschuss, 25. Juni 2013.
- Perampanel bei Epilepsie: Weiterhin keine Belege für Zusatznutzen. Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG), 15. August 2014, abgerufen am 9. Dezember 2014.
- Kirsten Sucker-Sket: Zweiter Anlauf für Fycompa®: IQWiG sieht weiterhin keinen Zusatznutzen. daz.online, 18. August 2014, abgerufen am 9. Dezember 2014.
- Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII – Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach § 35a SGB V – Perampanel. (PDF) Gemeinsamer Bundesausschuss, 6. November 2014, abgerufen am 9. Dezember 2014.
- Eisai will Einzeleinfuhr fortsetzen. Ärzte Zeitung, 12. Dezember 2014, abgerufen am 31. Januar 2015.
- Kirsten Sucker-Sket: Perempanel: Kostenfreies Import-Programm für Fycompa läuft aus. daz.online, 11. November 2015, abgerufen am 10. Juni 2016.
- Julia Borsch: Fycompa kehrt zurück. In: DAZ.online. 28. November 2017 (deutsche-apotheker-zeitung.de [abgerufen am 8. August 2018]).