Palaeocastor
Palaeocastor ist eine ausgestorbene Gattung der Nagetiere innerhalb der Familie der Biber. Fossilfunde liegen aus dem westlichen Nordamerika vor und gehören in das Obere Oligozän und Untere Miozän vor rund 30 bis 20 Millionen Jahren. Die Vertreter von Palaeocastor waren kleiner als heutige Biber und lebten abweichend von diesen in offenen Steppenlandschaften, wo sie sich von Gräsern ernährten. Aufgrund von markanten Skelettmerkmalen kann auf eine Anpassung an eine grabende Lebensweise geschlossen werden, wobei hauptsächlich die vorderen Zähne zum Einsatz kamen. Charakteristisch sind auch die von Palaeocastor hinterlassenen, komplexen unterirdischen Gänge, die teilweise recht häufig auftreten und bei denen ein spiralförmig gewundener, abwärtsführender Gang besonders augenscheinlich ist. Die fossil überlieferten Baue werden aufgrund dieser eigentümlichen Form unter der wissenschaftlichen Bezeichnung Daimonelix („Teufels-Korkenzieher“ oder „Dämonenschrauben“) geführt. Die Gattung Palaeocastor erhielt 1869 ihre Benennung, die ersten Grabgänge wurden 1891 beobachtet. Dass Palaeocastor mit Daimonelix in Verbindung steht, konnte Anfang des 20. Jahrhunderts durch gemeinsame Funde bewiesen werden.
| Palaeocastor | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
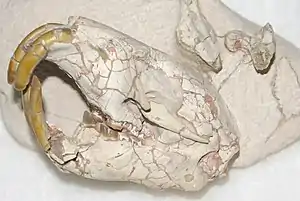
Schädel von Palaeocastor | ||||||||||||
| Zeitliches Auftreten | ||||||||||||
| Oberes Oligozän bis Unteres Miozän | ||||||||||||
| 29,7 bis 18,5 Mio. Jahre | ||||||||||||
| Fundorte | ||||||||||||
| ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name | ||||||||||||
| Palaeocastor | ||||||||||||
| Leidy, 1869 | ||||||||||||
Merkmale
Palaeocastor war ein relativ kleiner Vertreter ausgestorbener Biber. Ein nahezu vollständiges Skelett eines mittelgroßen Individuums erreichte eine Gesamtlänge von knapp 40 cm. Im Proportionsvergleich zu heutigen Arten besaß er ein Körpergewicht von 3,6 bis 3,8 kg.[1] Der Schädel war groß, aber relativ kurz und breit, analog zu den heutigen Bibern. Er wurde zwischen 5,9 und 8,2 cm lang, an den Jochbögen betrug die Breite 4,3 bis 6,6 cm. Der Schädel der größten Art war 9,2 cm lang und 8,8 cm breit.[2] Vor allem bei stärker unterirdisch lebenden Arten konnte der Schädel einen zuweilen sehr massiven Bau aufweisen mit kräftigen, verbreiterten Jochbögen und einem hohen Scheitelkamm. Das Rostrum war schmal und vergleichsweise länger als bei heutigen Bibern. Die Knochen, die das Rostrum bildeten (Nasenbein und Oberkiefer), zeigten leichte Verdickungen, die aber nicht so stark ausgebildet waren wie bei heute unterirdisch lebenden Nagetieren. Auch der Mittelkieferknochen wies einen kräftigen Bau auf, der hauptsächlich die großen Schneidezähne unterstütze. Das Stirnbein war breit und sehr kurz, das Merkmal wurde umso deutlicher, je stärker die Tiere eine grabende Lebensweise verfolgten. An den Scheitelbeinen befanden sich hinten zwei querstehende Knochenkämme, die als zusätzliche Muskelansatzstellen dienten. Abweichend von den heutigen Bibern oder dem ähnlich lebenden Stummelschwanzhörnchen nahm das Hinterhauptsbein den gesamten hinteren Schädelbereich ein und stand weitgehend senkrecht.[3][4][5]
Der Unterkiefer war sehr massiv gestaltet und ebenfalls kurz, auch er nahm an Robustizität zu, je mehr die Vertreter an eine unterirdische Lebensweise angepasst waren, was sich vor allem in der Tiefe und Breite des horizontalen Knochenkörpers widerspiegelte. Die Länge variierte von 5,9 bis 6,4 cm. Die massige Symphyse reichte etwa bis zur Hälfte des markant ausgeprägten Diastemas zwischen vorderer und hinterer Bezahnung. Auf der Unterseite befand sich ein Knochenauswuchs, an dem der Musculus digastricus ansetzte und der auch bei den heutigen Bibern vorkommt. Unterhalb des vierten Prämolaren lag ein großes Foramen mentale. Die Gelenkäste hatten einen extrem breiten Bau und nahmen rund die Hälfte des horizontalen Knochenkörpers ein. Dabei war der Kronenfortsatz (Processus coronoideus) höher als der Gelenkfortsatz (Processus condylaris). Das Gebiss zeigte eine deutliche Reduktion der Zahnanzahl, die Gebissformel lautete: . Somit bestand das Gebiss aus insgesamt 20 Zähnen. Alle Zähne waren extrem hochkronig (hypsodont). Der Schneidezahn besaß wie bei den rezenten Bibern eine äußerst kräftige und meißelartige Gestalt, seine Länge betrug bis zu 2,5 cm im Unterkiefer, im oberen Kiefer war etwas kürzer. Er steckte in sehr kräftigen, röhrenartigen Alveolen und ragte vor allem im Oberkiefer schräg nach vorn (procumbent). Insgesamt war er leicht gebogen, am oberen Ende wies er meist kräftige Schlifffacetten auf. Zur hinteren Bezahnung bestand ein Diastema, das im Oberkiefer bis zu 3 cm maß, im Unterkiefer nur gut die Hälfte an Länge beanspruchte. Der letzte Prämolar stellte mit einer Länge von 4 bis 4,5 mm und einem rechteckigen Umriss den jeweils größten Zahn dar, die Molaren wurden nach hinten kontinuierlich kleiner und nahmen eine quadratische Gestalt an, bis auf den hintersten, der rund oder dreieckig war. Die gesamte hintere Zahnreihe wies eine Länge von 1,2 bis 1,6 cm auf. Markant war vor allem das Kauflächenmuster der Backenzähne. Dieses setzte sich aus mehreren Eintiefungen (Fossetten) zusammen, die aus Zahnbein gebildet wurden und von Zahnschmelz umgeben waren. Form und Anzahl variierten stark mit dem Grad der Abnutzung der Zähne.[3][4][6]
Das postcraniale Skelett ist umfassend bekannt. Die Wirbelsäule setzte sich aus schätzungsweise 7 Hals-, 13 Brust-, 6 Lenden- , 5 Kreuzbein- und möglicherweise 18 Schwanzwirbel zusammen. Besondere Unterschiede zu den heutigen Bibern traten an der Schwanzwirbelsäule auf. Die Wirbelkörper hatten eine runde Form und nahmen auf den gesamten Schwanz hin kaum an Größe ab. Die Querfortsätze waren deutlich ausgeprägt, die vordersten Wirbel besaßen möglicherweise Chevronknochen auf der Unterseite, wie einige knöcherne Aufwölbungen vermuten lassen. Insgesamt erwies sich der Schwanz als kräftig und im Querschnitt deutlich rund. Der Oberarmknochen war mit 3,5 bis 4,6 cm sehr kurz und kompakt gebaut. Er besaß ein breites unteres und schmales oberes Gelenkende, an dem ein großer Gelenkkopf saß. Am Schaft trat seitlich ein massiger, teils plattenartig ausgebildeter Knochenkamm (Crista deltoidea) als Ansatzstelle für die Brust- und Schultermuskulatur auf, der vom oberen Ende bis zur Hälfte der Diaphyse reichte. Die Elle maß 4,1 bis 5,6 cm und war am oberen Ende recht breit, wurde nach unten hin dünner. Insgesamt war sie seitlich abgeplattet, der obere Gelenkfortsatz (Olecranon) hatte eine Länge von rund 1 cm. Die Speiche war etwas leichter gebaut als die Elle und besaß einen runden Schaft und einen großen Kopf. Beide Unterarmknochen waren nicht miteinander verwachsen. Ebenso war der Oberschenkelknochen relativ grazil und am Schaft nicht so abgeflacht wie bei den rezenten Bibern. Die Länge betrug 4,8 bis 5,4 cm, die Gelenkkugel saß auf einem deutlichen, wenn auch kurzen Hals. Den großen und kleinen Trochanter (Rollhügel) verband im Unterschied zu den rezenten Formen kein Knochensteg. Ein dritter Trochanter bestand an der Mitte des Schaftes, war aber nicht sehr ausgeprägt. Das untere Gelenkende zeigte zwar einen leicht asymmetrischen Bau, die beiden Gelenkrollen besaßen aber etwa die gleiche Länge. Die Knochen des unteren Beinabschnittes hatten noch nicht die auffälligen Streckungen der heutigen Biber und waren etwas kürzer oder gleich lang wie der obere Beinabschnitt. Das Schienbein war nicht mit dem Wadenbein verwachsen, der Schaft erwies sich rundlichen im Querschnitt und besaß entlang der Längsachse eine leichte Drehung. Arme und Beine endeten in jeweils fünfstrahlige Hände und Füße. Die einzelnen Knochen, vor allem die Metapodien und Phalangen, waren kräftig gebaut sowie kurz und breit. Die jeweiligen Endglieder der Finger und Zehen endeten spitz, die der Hand übertrafen jene des Fußes an Größe.[3][4]
Fossilfunde


Funde von Palaeocastor sind überwiegend aus dem westlichen Teil Nordamerikas bekannt und stammen aus den US-Bundesstaaten Nebraska, Wyoming, South Dakota und Montana. Sie datieren in das Obere Oligozän und das Untere Miozän (lokalstratigraphisch Arikareeum) und sind so zwischen 30 und 20 Millionen Jahre alt. Zu den frühesten Funden gehören mehrere Teilskelette von Exemplaren unterschiedlichen Individualalters aus der Fort-Logan-Formation in Montana, die vor etwa 29 bis 27 Millionen Jahren starben.[3] Ähnlich alt sind die Funde der Sharps-Formation, die an den Ufern des White River nahe der Ortschaft Wounded Knee in South Dakota aufgeschlossen ist und von wo auch das Typusmaterial der Gattung in Form eines weitgehend vollständigen Schädels und mehrerer weiterer Schädelfragmente herstammt. Auch aus der überlagernden Monroe-Creek-Formation konnten Funde, etwa ein Teilschädel, geborgen werden.[7][8] Herausragende Bedeutung besitzt aber die Harrison-Formation, die die Monroe-Creek-Formation überdeckt und über weite Gebiete des westlichen Nebraska und östlichen Wyoming verbreitet ist. Sie besteht aus massiven, graubraunen und feinkörnigen Sandsteinen, die teilweise auf ein ehemaliges Flussbett, abseits von diesem auf von Wind eingetragenen Löss zurückgehen. Vor allem in den von Löss beeinflussten Sedimentlagen kamen unzählige Reste von Palaeocastor zum Vorschein, die zum Teil auch vollständige Skelette einschließen. Die Harrison-Formation gehört dem Unteren Miozän an und wurde mit Hilfe radiometrischer Messungen an eingeschalteten vulkanischen Aschelagen auf ein Alter von 21,3 bis 22,9 Millionen Jahre bestimmt.[9][10]

Aus den Lössbildungen der Harrison-Formation stammen auch Spurenfossilien in Form von schraubenartig gewundenen Grabgängen, die unter dem Ichnotaxon Daimonelix (teilweise auch Dæmonelix; „Teufels-Korkenzieher“, auch „Geister-“ oder „Dämonenschrauben“) geführt werden. Hierbei handelt es sich um spiralartig, häufig um eine senkrechte Achse gewundene Gänge, die einen Durchmesser von 11 bis 15 cm erreichen und bis in 210 bis 275 cm Tiefe in den Untergrund eindringen, wobei der durchschnittliche Neigungswinkel 25 bis 30° beträgt. Am unteren Ende schließt sich ein langgestreckter Gang an, der zumeist in einem Winkel von 2 bis 37° aufsteigt und mit 15 bis 22 cm Durchmesser auffällig größer ist. Die Länge dieses Ganges kann 200 bis über 450 cm erreichen. Auffällig sind kleinere seitliche Ausbuchtungen, die in der Regel nur bei flacher ansteigenden Gängen auftreten. Teilweise ist die Anzahl der Grabgänge in der Harrison-Formation extrem hoch, während in der unterlagernden Monroe-Creek-Formation nur vereinzelt derartige Spurenfossilien auftreten. Die Fossilien wurden 1891 von Erwin Hinckly Barbour erstmals in Aufschlüssen des nordwestlichen Nebraska beobachtet und im Folgejahr unter der wissenschaftlichen Bezeichnung Daimonelix öffentlich bekannt gemacht. In seiner Publikation nahm Barbour an, dass es sich um Relikte riesiger Süßwasser-Schwämme handelt, wobei der untere Fortsatz eine Art Wurzelstock (Rhizom) darstelle.[11] Bereits 1893 wurde aber von Edward Drinker Cope und von Theodor Fuchs unabhängig voneinander erkannt, dass es sich hierbei um Grabgänge von Nagetieren handelt.[12][13] Den letztendlichen Nachweis erbrachte im Jahr 1904 der Fund eines weitgehend vollständigen Skelettes eines ausgestorbenen Bibers, welches sich in der wurzelstockartigen Erweiterung fand.[14][4] Demzufolge handelt es sich um die Baue von fossilen Bibern der Gattungen Palaeocastor und Pseudopalaeocastor. Die wurzelstockartige Erweiterung kann dabei als die eigentliche Wohnkammer des Baus gedeutet werden, die mit einzelnen Seitenkammern umso komplexer gebaut sind, je niedriger der Aufstiegswinkel ist. Ihr Aufsteigen von der Basis des korkenzieherartigen Ganges wird als Schutz vor eindringende Feuchtigkeit interpretiert. Weitere Untersuchungen ließen auch die Kratzmarken der Tiere zu Tage treten, die sie mit ihren Krallen und Zähnen hinterließen.[10]
Paläobiologie

Palaeocastor gehört zu einer Gruppe fossiler Biber in Nordamerika, die an eine unterirdische (fossoriale) Lebensweise angepasst waren. Zu diesen sind ebenfalls die nahe verwandten Formen Pseudopalaeocastor, Fossorcastor oder Euhapsis, aber auch der weiter entfernte verwandte Migmacastor zu stellen.[15][16] Das Auftreten dieser im Untergrund grabenden Bibergattungen fällt in eine Zeit kühler werdenden Klimas im Oberen Oligozän und Unteren Miozän. Dies ging mit der Ausbildung offener Landschaften bis hin zu Steppen und in Folge dadurch einer stärkeren Radiation der Gräser einher, was den Tieren die Möglichkeit zur Erschließung neuer ökologischer Nischen gab. Innerhalb der Gattung Palaeocastor zeigen die einzelnen Arten aber unterschiedlich starke Anpassungen an die grabende Lebensweise. Am stärksten entwickelt ist sie bei den stammesgeschichtlich jüngeren, untermiozänen Formen Palaeocastor fossor und Palaeocastor magnus, weniger markant bei dem älteren, oberoligozänen Palaeocastor peninsulatus.[3] Die außergewöhnliche Form der schraubenförmigen Grabbaue ist dabei eventuell ein Resultat der sich verändernden Klimabedingungen mit stärker ausgeprägten Jahreszeiten. Die extreme Tiefe und spiralartige Gestaltung des abwärtsführenden Ganges verminderte die Luftzirkulation zwischen der Oberfläche und der Wohnkammer und sorgte somit dort für ausgeglichene Temperaturen.[17]
Insgesamt war Palaeocastor ein Bewohner offener Steppen, Fossilfunde stehen in der Regel nicht in Verbindung mit Wasserstellen. Er ähnelte in seiner Lebensweise den heutigen Präriehunden, war aber etwas größer. Aufgrund der hochkronigen Backenzähne kann auf eine Spezialisierung auf harte Gräser geschlossen werden, was wiederum die Annahme zulässt, dass der Großteil der Nahrung oberirdisch erworben wurde. Am Skelett finden sich zahlreiche Merkmale als Hinweis auf eine grabende Lebensweise, die ähnlich ausgeprägt sind wie bei den Präriehunden. So sind der dritte und vierte Strahl der Hände und Füße leicht verlängert, die Krallen eher kurz und breit, was als typische Kennzeichen fossorialer Säugetiere aufzufassen ist, die ihre Gliedmaßen zum Graben einsetzen (scratch-digging), vergleichbar der heutigen Flachland-Taschenratten innerhalb der Nagetiere. Der Schwanz hat abweichend von den heutigen Bibern einen runden Querschnitt und ist nicht sonderlich lang. Der Schädel zeigt einen breiten und oben abgeflachten Bau. Daneben gibt es noch deutliche Anzeichen im Gebiss, die auf grabende Tätigkeiten hinweisen. Etwa an den Schneidezähnen, die ebenfalls eine flache Gestalt besitzen, so dass gerade Schneidkanten entstehen. Bemerkenswert ist vor allem die schräg nach vorn gerichtete (procumbente oder proödonte) Stellung der oberen Schneidezähne, was einen Einsatz der Zähne zum Graben indiziert (chisel-tooth digging). In diesem Merkmal ähnelt Palaeocastor eher der heutigen Gebirgs-Taschenratte, die zum Graben überwiegend die Zähne nutzt.[10] Die oberen Schneidezähne dienten allerdings weniger dem Graben selbst, sondern verankerten durch ihre nach vorn geschobene Position den Schädel im Boden. Die besondere Position der Schneidezähne bewirkte zudem, dass sie weit vor dem Unterkiefer saßen und so das Eindringen von Erde in das Maul mit verhinderten. Die eigentliche Grabtätigkeit führten die unteren Schneidezähne aus, die steiler im Maul standen. Die dafür notwendige Kaumuskulatur ist aufgrund des Scheitelkammes und der breiten Jochbögen annehmbar.[18][5] Dabei zeigt eine Fundserie aus der Fort-Logan-Formation des Oberen Oligozän im zentralen Montana, die von juvenilen bis zu adulten Individuen eines frühen Vertreters von Palaeocastor reicht, dass offensichtlich innerhalb der Ontogenese eines Tieres eine stärkere Anpassung vom scratch-digging zum chisel-tooth digging erfolgte.[3] Dies spiegelt unmittelbar auch die stammesgeschichtliche Entwicklung wider, bei der sich eine Zunahme des Zahneinsatzes beim Graben abzeichnet, was unter anderem in der stärker werdenden schrägen Ausrichtung der oberen Schneidezähne erkennbar ist, die von 90° bei älteren Formen (etwa der Wert heutiger Biber) auf bis zu 114° bei späteren Arten ansteigt.[19]
Untersuchungen an den Daimonelix-Grabgängen in der Harrison-Formation ergaben, dass Palaeocastor den Spiralgang seines Baues überwiegend mit den Zähnen anlegte und das anfallende Erdmaterial mit den Vorderfüßen wegschaufelte. Ob es dann mit den Hinterfüßen oder durch eine Körperdrehung des Tieres mit der flachen Stirn des Kopfes an die Oberfläche befördert wurde, ist unklar. Bemerkenswert ist, dass beim Graben mit den Zähnen die Kopfhaltung des Tieres entscheidend für die Ausrichtung der abwärtsführenden Spirale war, da in jeweils der Hälfte der dokumentierten Fälle rechts- und linksdrehende Spiralen nachgewiesen werden konnten; somit liegt keine bevorzugte Drehrichtung des schraubenartigen Ganges und damit keine ausgewiesene „Händigkeit“ von Palaeocastor vor. Die Wohnkammer dagegen wurde sowohl mit den Schneidezähnen als auch mit den Klauen der Vorderfüße angelegt. Allerdings beschränken sich die nachgewiesenen Krallenmarken auf die Seitenwände und den Boden, während an der Decke Zahnspuren dominieren. Auffällig ist auch, dass die einzelnen Baue nur selten Fluchtgänge aufweisen. Möglicherweise deutet das darauf hin, dass Palaeocastor seine Baue verteidigte, wozu die engen, schraubenartigen Gänge, deren Durchmesser ein einzelnes Tier kaum übertraf, gut geeignet waren. In einzelnen Fällen wurden Reste von Zodiolestes, einem ausgestorbenen Vertreter der Marder in einigen Bauen entdeckt. Lokal können die Daimonelix-Strukturen durchaus in großer Häufigkeit auftreten mit mehreren Hundert Exemplaren auf engem Raum. Die oberen Ausgänge liegen in den jeweiligen Regionen dabei zumeist in einem schichtsynchronen Paläoboden als Relikt der ehemaligen Oberfläche, der durch fossilisierte Pflanzenwurzeln angezeigt wird, was sie als weitgehend zeitgleich ausweist. Es ist dadurch zu Vermuten, dass die einzelnen Populationen von Palaeocastor große Kolonien bildeten, vergleichbar den heutigen Präriehunden. Ob die ausgestorbenen Biber dabei in einem ähnlichen Sozialsystem lebten, ist unklar.[10]
Systematik
Innere Systematik der Biber, hauptsächlich der Palaeocastorinae, nach Samuels et al. 2009[5]
|

Palaeocastor ist eine heute ausgestorbene Gattung aus der Familie der Biber, welche heute nur noch zwei Arten innerhalb der Gattung Castor enthält. Die Familie der Biber hat eine reiche Fossilgeschichte, die bis in das Obere Eozän zurückreicht, und weist dadurch zahlreiche Angehörige in mehreren Unterfamilien auf. Die heutigen Biber gehören der Unterfamilie der Castorinae an. Sie bilden zusammen mit ihrer Schwestergruppe, den Castoroidinae, zu denen unter anderem die bekannteren Gattungen Castoroides (Riesenbiber) und Trogontherium (Altbiber) zu stellen sind, eine Gruppe semi-aquatisch lebender Vertreter. Sie stellen auch ein stammesgeschichtlich jüngeres Glied innerhalb der Entwicklung der Biber dar. Palaeocastor wird dagegen in die Unterfamilie der Palaeocastorinae eingeordnet, deren Mitglieder auf das Oligozän und Miozän beschränkt sind. Seine nächsten Verwandten sind Fossorcastor und Pseudopalaeocastor. Die Schwestergruppe der Palaeocastorinae wiederum bilden die Migmacastorinae. Die Angehörigen beider Unterfamilien passten sich an eine überwiegend terrestrische Lebensweise in offenen Landschaften an und waren teilweise auf eine grabende Tätigkeit spezialisiert.[20][5][16]
Sowohl die semi-aquatische Gruppe (Castorinae und Castoroidinae) als auch die terrestrisch-unterirdisch lebende Gruppe (Palaeocastorinae und Migmacastorinae) bilden phylogenetischen Untersuchungen zufolge jeweils eine monophyletische Einheit, wobei erstere genetischen Untersuchungen zufolge seit wenigstens rund 19,7 Millionen Jahren besteht.[21] Da auch heutige Biber teilweise Gräben und Kanäle in den Flussufern anlegen und die als semi-aquatisch geltenden Steneofiber aus dem Untermiozän Europas und Nothodipoides des Mittelmiozäns Nebraskas ebenfalls Wohnhöhlen anlegten,[22][23] kann davon ausgegangen werden, dass der gemeinsame Vorfahre der beiden Gruppen bereits über Anpassungen zum Graben verfügte. Die primär grabenden, Offenlandschaften bewohnenden Biber starben aber höchstwahrscheinlich in Konkurrenz zu anderen derartig lebenden Säugetieren, etwa die Mylagaulidae aus der Verwandtschaft der Stummelschwanzhörnchen, im Verlauf des Miozäns aus. Das charakteristische Benagen von Bäumen entwickelte sich innerhalb der semi-aquatischen Gruppe aber offensichtlich nur zweimal, bei Castor und bei Dipoides, letzteres gehört in die Verwandtschaft des Alt- und Riesenbibers. Es entstand möglicherweise aus der ursprünglichen Nutzung der uferbegleitenden Gebüschvegetation. Da sich dieses Merkmal somit innerhalb der semi-aquatischen Bibergruppe herausbildete, ist es als ein abgeleitetes Merkmal aufzufassen.[5][16]
Im Verlauf der Forschungsgeschichte wurden zahlreiche Arten von Palaeocastor beschrieben, weitgehend anerkannt sind folgende:[5][16][3]
- P. fossor Peterson, 1905
- P. magnus Romer & McCormack, 1928
- P. nebrascensis Leidy, 1856
- P. pensinsulatus Cope, 1881
- P. simplicidens Matthew, 1907
- P. wahlerti Korth, 2001
Anfänglich wurden die meisten Arten anderen Gattungen, zumeist Castor oder Steneofiber zugewiesen. Das ebenfalls 1905 von Peterson eingeführte Steneofiber barbouri[4] galt teilweise auch zu Palaeocastor gehörig, bildet heute aber die Gattung Pseudopalaeocastor. Ebenso wurde das 1879 von Cope benannte Steneofiber gradatus zeitweilig innerhalb von Palaeocastor geführt, später aber zu Cpacikala verwiesen.[5][19]
Die wissenschaftliche Erstbeschreibung von Palaeocastor führte der amerikanische Paläontologe Joseph Leidy im Jahr 1869 durch. Dafür standen ihm mehrere Fossilfunde, darunter auch ein fast vollständiger Schädel eines Individuums, aus Aufschlüssen des White River im heutigen Badlands-Nationalpark im Südwesten des US-Bundesstaates South Dakota zur Verfügung (Mauvaises Terres of White River), die Ferdinand Vandeveer Hayden entdeckt hatte. Er ordnete der Gattung die Art P. nebrascensis zu, die von ihm mehr als zehn Jahre zuvor unter dem Gattungsnamen Steneofiber eingerichtet worden war. Der Holotyp umfasst den von Leidy verwendeten Schädel, besitzt aber keine ausgewiesene Exemplarnummer. Er wird in der Academy of Natural Sciences in Philadelphia aufbewahrt.[7][8]
Einzelnachweise
- P. S. Reynolds: How big is a giant? The importance of method in estimating body size of extinct mammals. Journal of Mammalogy 83 (2), 2002, S. 321–332
- Alfred Sherwood Romer und J. T. McCormack: A large Palaeocastor from the Lower Miocene. The American Journal of Science, series 5 15 (85), 1928, S. 58–60
- Jonathan Jean-Michel Calede: Skeletal Morphology of Palaeocastor peninsulatus (Rodentia, Castoridae) from the Fort Logan Formation of Montana (early Arikareean): Ontogenetic and Paleoecological Interpretations. Journal of Mammalian Evolution 21, 2014, S. 223–241
- Olof August Peterson: Description of new rodents and discussion of the origin of Daemonelix. Memoirs of the Carnegie Museum 2 (4), 1905, S. 139–202
- Joshua X. Samuels und Blaire Van Valkenburgh: Craniodental Adaptations for Digging in Extinct Burrowing Beavers. Journal of Vertebrate Paleontology 29 (1), 2009, S. 254–268
- Clara Stefen: Morphometric considerations of the teeth of the palaeocastorine beavers Capacikala, Palaeocastor and "Capatanka". Palaeontologia Electronica 13 (1), 2010, S. 2A (online)
- Joseph Leidy: Extinct Mammalia of Dakota and Nebraska, including an account of some allied forms from other localities. Journal of the Academy of Natural Sciences Philadelphia, 7, 1869, S. 23–472 ()
- James Reid Macdonald: The Miocene faunas from the Wounded Knee area of western South Dakota. Bulletin of the American Museum of Natural History 125, 1969, S. 143–238
- J. Graham: Agate Fossil Beds National Monument Geologic Resources Inventory Report. Natural Resource Report NPS/NRPC/GRD/NRR—2009/080. National Park Service, Denver, Colorado, 2009 ()
- Larry D. Martin und Debra K. Bennett: The burrows of the Miocene beaver Palaeocastor, Western Nebraska, U.S.A. Palaeogeography, Palaeoclimatology, Palacoecology 22, 1977, S. 173–193
- Erwin Hinckly Barbour: Notice of new gigantic fossils. Science 19, 1892, S. 99–100
- Edward Drinker Cope: A supposed new order of gigantic fossil from Nebraska. The American Naturalist 27, 1893, S. 559–569
- Theodor Fuchs: Ueber die Natur von Daimonelix Barbour. Annalen des K.K. Naturhistorischen Hofmuseums - Notizen 8, 1893, S. 91–94 ()
- Olof August Peterson: Recent observations upon Daemonelix. Science 20, 1904, S. 344–345
- William W. Korth und Natalia Rybczynski: A new unusual castorid (Rodentia) from the Earliest Miocene of Nebraska. Journal of Vertebrate Paleontology 23 (3), 2003, S. 667–675
- Natalia Rybczynski: Castorid Phylogenetics: Implications for the Evolution of Swimming and Tree-Exploitation in Beavers. Journal of Mammalian Evolution 14, 2007, S. 1–35
- Robert C. Meyer: Helical burrows as a palaeoclimate response: Daimonelix by Palaeocastor. Palaeogeography, Palaeoclimatology, Palaeoecology 147, 1999, S. 291–298
- Barbara R. Stein: Morphology of subterranean rodents. In: Eileen A. Lacey, James L. Patton und Guy N. Cameron (Hrsg.): Life Underground: The Biology of Subterranean Rodents. University of Chicago Press, Chicago, 2000, S. 19–61
- Clara Stefen: Cranial morphology of the Oligocene beaver Capacikala gradatus from the John Day Basin and comments on the genus. Palaeontologia Electronica 17 (2), 2014, S. 25A (online)
- William W. Korth: Comments on the Systematics and Classification of the Beavers (Rodentia, Castoridae). Journal of Mammalian Evolution 8 (4), 2001, S. 279–296
- Georgios Xenikoudakis, Mayeesha Ahmed, Jacob Colt Harris, Rachel Wadleigh, Johanna L. A. Paijmans, Stefanie Hartmann, Axel Barlow, Heather Lerner und Michael Hofreiter: Ancient DNA reveals twenty million years of aquatic life in beavers. Current Biology 30, 2020, S. R110–R111, doi:10.1016/j.cub.2019.12.041
- Marguerite Hugueney and François Escuillié: Fossil Evidence for the Origin of Behavioral Strategies in Early Miocene Castoridae, and Their Role in the Evolution of the Family. Paleobiology 22 (4), 1996, S. 507–513
- William W. Korth: The skull of Nothodipoides (Castoridae, Rodentia) and the occurence of fossorial adaptions in beavers. Journal of Paleontology 81 (6), 20078, S. 1533–1537