Osmium(IV)-chlorid
Osmium(IV)-chlorid ist eine anorganische chemische Verbindung des Osmiums aus der Gruppe der Chloride. Sie wurde zuerst 1909 synthetisiert.[4]
| Kristallstruktur | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
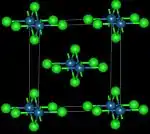 | ||||||||||||||||
| Hochtemperaturform | ||||||||||||||||
| Kristallsystem |
kubisch | |||||||||||||||
| Raumgruppe |
P4332 (Nr. 212) oder P4132 (Nr. 213) (beide Raumtemperaturmodifikation) | |||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Osmium(IV)-chlorid | |||||||||||||||
| Andere Namen |
Osmiumtetrachlorid | |||||||||||||||
| Verhältnisformel | OsCl4 | |||||||||||||||
| Kurzbeschreibung |
roter Feststoff[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 332,012 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest[1] | |||||||||||||||
| Dichte | ||||||||||||||||
| Siedepunkt | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Gewinnung und Darstellung
Osmium(IV)-chlorid kann auch durch Disproportionierung von Osmium(III)-chlorid bei 500 °C im Vakuum dargestellt werden.[5]
Ebenfalls möglich ist die Darstellung durch Reflux von Thionylchlorid mit Osmium(VIII)-oxid.[6]
Die schwarze Hochtemperaturform kann durch Reaktion von Osmium(VIII)-oxid mit Tetrachlorkohlenstoff oder Osmium mit Thionylchlorid bei 460 °C.[6]
Auch durch Reaktion von Osmium mit Chlor bei etwa 700 °C kann die Hochtemperaturform gewonnen werden.[4]
Eigenschaften
Osmium(IV)-chlorid ist ein roter bis brauner paramagnetischer Feststoff.[1][6] Es löst sich in Wasser, Salzsäure[6] und Ethanol mit gelber Farbe, zersetzt sich in Lösung jedoch rasch.[7] Die Kristallstruktur besteht aus kantenverknüpften [OsCl2]Cl4/2 Oktaedern in linearer Anordnung.[8] Es existiert auch eine schwarze Hochtemperaturform die in Chlor oder Vakuum zu gelben Dämpfen sublimiert[9] die je nach Synthesemethode entsteht.[10] Bei Temperaturen über 400 °C bildet sie mit Sauerstoff Osmiumoxidtetrachlorid OsOCl4.[6] Die Hochtemperaturform besitzt eine orthorhombische Kristallstruktur mit der Raumgruppe Cmmm (Raumgruppen-Nr. 65), während die Normaltemperaturform eine kubische Kristallstruktur mit der Raumgruppe P4332 (Raumgruppen-Nr. 212) oder Raumgruppe P4132 (Raumgruppen-Nr. 213) besitzt.[3][10]
Einzelnachweise
- Datenblatt OSMIUM TETRACHLORIDE, Aldrich bei Sigma-Aldrich, abgerufen am 31. Januar 2016 (PDF).
- Carl L. Yaws: The Yaws Handbook of Physical Properties for Hydrocarbons and Chemicals Physical Properties for More Than 54,000 Organic and Inorganic Chemical Compounds, Coverage for C1 to C100 Organics and Ac to Zr Inorganics. Gulf Professional Publishing, 2015, ISBN 978-0-12-801146-1, S. 740 (eingeschränkte Vorschau in der Google-Buchsuche).
- F. Albert. Cotton, Catherine E. Rice: Structure of the high-temperature form of osmium(IV) chloride. In: Inorganic Chemistry. 16, 1977, S. 1865, doi:10.1021/ic50174a008.
- Otto Ruff, Ferd. Bornemann: über das Osmium, seine analytische Bestimmung, seine Oxyde und seine Chloride. In: Zeitschrift für anorganische Chemie. 65, 1910, S. 429, doi:10.1002/zaac.19100650126.
- G. Singh: Chemistry Of Lanthanides And Actinides. Discovery Publishing House, 2007, ISBN 81-8356-241-8, S. 307 (eingeschränkte Vorschau in der Google-Buchsuche).
- Jane E. Macintyre: Dictionary of Inorganic Compounds. CRC Press, 1992, ISBN 978-0-412-30120-9, S. 2963 (eingeschränkte Vorschau in der Google-Buchsuche).
- George Fownes: A Manual of Elementary Chemistry, Theoretical and Practical. H.C. Lea, 1873, S. 388 (eingeschränkte Vorschau in der Google-Buchsuche).
- Christoph Janiak, Hans-Jürgen Meyer, Dietrich Gudat, Ralf Alsfasser: Riedel Moderne Anorganische Chemie. Walter de Gruyter, 2012, ISBN 978-3-11-024901-9, S. 356 (eingeschränkte Vorschau in der Google-Buchsuche).
- Georg Bauer, Konrad Ruthardt: Elemente der Achten Nebengruppe Platinmetalle Platin · Palladium · Rhodium · Iridium Ruthenium · Osmium. Springer-Verlag, 2013, ISBN 978-3-662-28796-5, S. 157 (eingeschränkte Vorschau in der Google-Buchsuche).
- Paul Machmer: On the polymorphism of osmium tetrachloride. In: Chemical Communications (London). 1967, S. 610a, doi:10.1039/C1967000610A.
