Niementowski-Reaktion
Die Niementowski-Reaktion ist eine Namensreaktion aus der organischen Chemie. Sie wurde 1895 erstmals von dem polnischen Chemiker Stefan Niementowski (1876–1925) dokumentiert.
Übersichtsreaktion
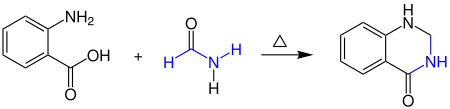
Aus Anthranilsäure und einem Amid wird unter Hitzeeinwirkung ein Chinazolin gebildet:
Allgemeines
Unter der Niementowski-Reaktion bzw. Niementowski-Synthese versteht man im Allgemeinen die Bildung von Chinazolin aus Anthralinsäure und Amiden. Allerdings sind die Namen Niementowski-Kondensation und Niementowski-4-Oxochinazolin Synthese auch gebräuchlich. Für die Reaktion wird nicht nur eine hohe Temperatur im bereich von 155–160 °C, sondern auch eine lange Reaktionszeit von um die 4 Stunden benötigt. Es ist zudem eine höhere Ausbeute bei kürzerkettigen Amiden wie Formamid und Acetamid zu beobachten, wobei längerkettige Amide die Ausbeute verringern.[1][2] Diese Ringschlussreaktion konnte unter anderem auch mit einigen Anthralsäurederivaten erfolgreich durchgeführt werden.[3] Ähnliche Reaktionen bzw. Ringbildungen finden sich bei der Friedländer-Chinolin-Synthese und der Pfitzinger-Reaktion.
Vorgeschlagener Reaktionsmechanismus
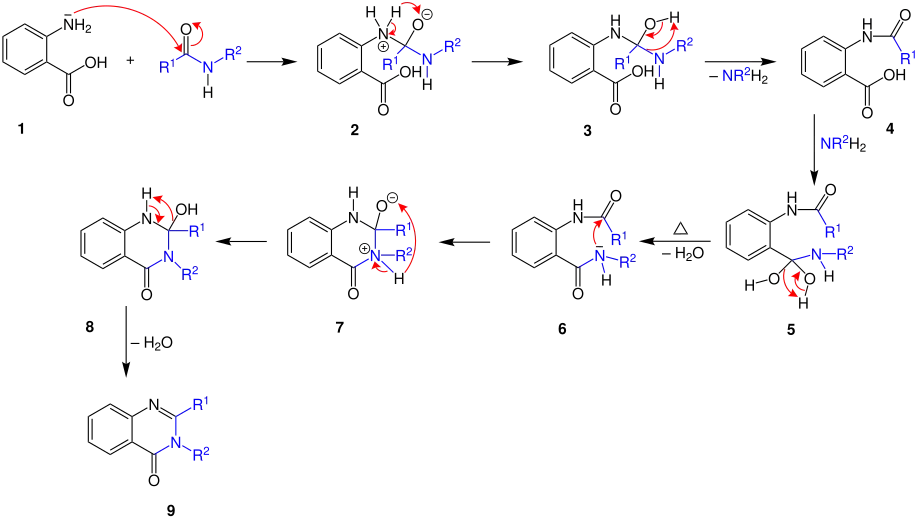
Im ersten Schritt findet ein nucleophile Addition des Stickstoffs der Anthranilsäure an die Carbonylgruppe des Amids statt. Dadurch wird der Stickstoff in 2 positiv und es findet ein dementsprechendes Umklappen der Elektronen statt, sodass sich bei der Reaktion von 3 zu 4 ein primäres Amin abspaltet. Dieses greift sogleich im nächsten Schritt die Carbonylgruppe der Anthralinsäure nucleophil an. unter Hitzeeinwirkung wird Wasser abgespalten und das Amid 6 gebildet. 6 kann durch erneuten nucleophilen Angriff auf die gegenüberliegende Carbonylgruppe cyclisieren. Durch erneute Kondensation wird das Endprodukt 9 erhalten:[4]
Niementowski-Chinolin-Synthese
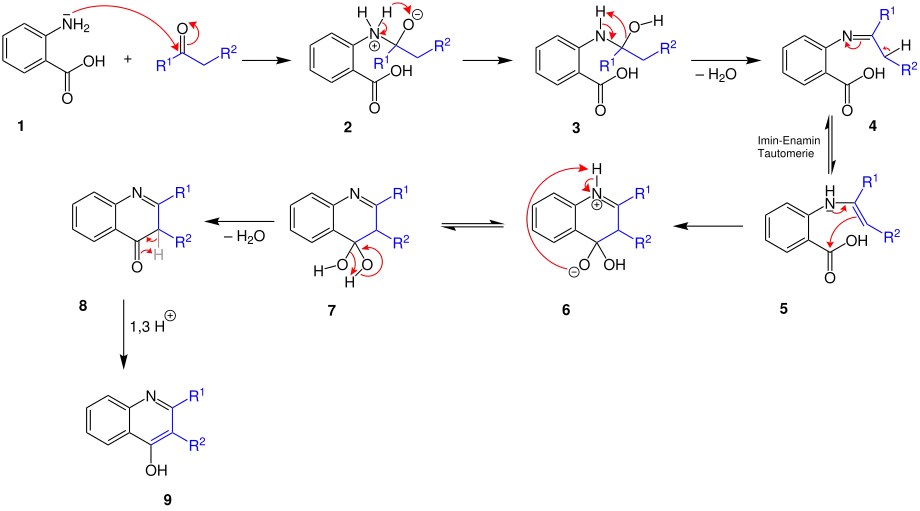
Eine Variation der Niementowski-Reaktion ist die Niementowski-Chinolin-Synthese.[5] Hierbei reagiert auch unter hohen Temperaturen und langer Reaktionszeit die Anthranilsäure mit Ketonen oder Aldehyden zu Chinolin. Diese Reaktion wurde sogar noch vor der Niementowski-Chinazolin-Reaktion entdeckt.[6] Sie ist der Friedländer-Chinolin-Synthese sehr ähnlich, jedoch ist hier die Zugabe einer Base als Katalysator nicht nötig und es gibt in wenigen Zwischenschritten kleine Unterschiede.
Die ersten zwei Schritte verlaufen wie bei der Niemtwoski-Chinolin-Synthese. Im dritten Schritt wird allerdings anstatt eines primären Amins Wasser abgespalten. Durch eine Imin-Enamin-Tautomerie findet eine Elektronenverschiebung statt, welche zur reaktiven Zwischenstufe 5 führt. Nun findet ein elektrophil bedingter Ringschluss statt. Über eine Protonenverschiebung entsteht über die Zwischenstufe 6 das geminales Diol 7, welches nur in wässrigem Medium einigermaßen stabil ist. Unter Wasserabspaltung entsteht aus 7 über 8 nun das Chinolin 9:
Literatur
- Zerong Wang:Comprehensic Organic Name Reactions and Reagents, Volume 2, Wiley, 2009, S. 2054–2057, ISBN 978-0-471-70450-8.
- Bradford P. Mundy, Michael G Ellerd, Frank G. Favaloro Jr.:Name Reactions and reagents in Organic Syntheses, second Edition, Wiley-Interscience, 2005, S. 259,314 und 462, ISBN 0-471-22854-0.
- The Merck Index, 9. Auflage, Merck & Co.,Inc., U.S.S., 1976, ONR-63, ISBN 0911910-26-3.
Einzelnachweise
- Marston Taylor Bogert, August Henry Gotthelf: Journal of the American Chemical Society. Band 22, 1900, S. 129–132, doi:10.1021/ja02041a003.
- Marston Taylor Bogert, William Flowers Hand: Journal of the American Chemical Society. Band 28, 1906, S. 94–104, doi:10.1021/ja01967a012.
- Robert C. Elderfield, Thurmond A. Williamson, Walter J. Gensler, Chester B. Kremer: Journal of Organical Chemistry. Band 12, 1947, S. 405–421, doi:10.1021/jo01167a007.
- Zerong Wang: Comprehensic Organic Name Reactions and Reagents, Volume 2, Wiley, 2009, S. 2055, ISBN 978-0-471-70450-8.
- Bradford P. Mundy, Michael G. Ellerd, Frank G. Favaloro Jr.: Name Reactions and reagents in Organic Syntheses, 2nd Edition, Wiley-Interscience, 2005, S. 314, ISBN 0-471-22854-0.
- S. Niemtowski: European Journal of Inorganic Chemistry. Band 27, 1894, S. 1394–1403, doi:10.1002/cber.18940270242.