Nickel(II)-titanat
Nickel(II)-titanat ist eine anorganische chemische Verbindung des Nickels aus der Gruppe der Titanate.
| Kristallstruktur | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
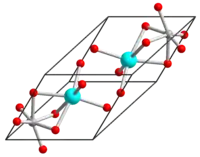 | ||||||||||
| _ Ti4+ _ Ni2+ _ O2− | ||||||||||
| Allgemeines | ||||||||||
| Name | Nickel(II)-titanat | |||||||||
| Andere Namen |
| |||||||||
| Verhältnisformel | NiTiO3 | |||||||||
| Kurzbeschreibung |
gelbliches geruchloses Pulver[1] | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 154,56 g·mol−1 | |||||||||
| Aggregatzustand |
fest[2] | |||||||||
| Dichte |
5,07 g·cm−3[1] | |||||||||
| Schmelzpunkt | ||||||||||
| Löslichkeit |
praktisch unlöslich in Wasser[3] | |||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||
Gewinnung und Darstellung
Nickel(II)-titanat kann durch Reaktion von Nickel oder Nickel(II)-oxid mit Titandioxid bei Temperaturen über 1000 °C oder durch Reaktion von Nickelstearat und Tetra-n-butyltitanat oder Nickel(II)-hydroxid mit Titandioxid in Cetyltrimethylammoniumbromidlösungen gewonnen werden.[5][6][7]
Eigenschaften
Nickel(II)-titanat ist ein gelblicher Feststoff, der praktisch unlöslich in Wasser ist.[1] Er besitzt eine trigonale Kristallstruktur vom Ilmenittyp mit der Raumgruppe R3 (Raumgruppen-Nr. 148).[1] Er ist ein n-Typ-Halbleiter mit einer Bandlücke von 2,18 eV.[5]
Verwendung
Nickel(II)-titanat wird als gelbes Pigment (mit hohem Reflexionsgrad auch im Infrarotbereich[8]) und für die Photokatalyse verwendet.[5][9]
Einzelnachweise
- R. Blachnik: Taschenbuch für Chemiker und Physiker Band 3: Elemente, anorganische Verbindungen und Materialien, Minerale. Springer-Verlag, 2013, ISBN 978-3-642-58842-6, S. 646 (eingeschränkte Vorschau in der Google-Buchsuche).
- Eintrag zu Nickel-Titantrioxid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 23. Juli 2016. (JavaScript erforderlich)
- iarc.fr: Nickel and nickel compound - IARC Monography 49, abgerufen am 5. Juli 2016
- D. C. Azubike, A. Chrysanthou, B. S. Terry: Kinetic dissociation of nickel titanate and nickel tungstate in oxygen potential gradients. In: Journal of Materials Science. 29, 1994, S. 2957, doi:10.1007/BF01117607.
- M.A. Ruiz-Preciado, A. Kassiba, A. Gibaud, A. Morales-Acevedo: Comparison of nickel titanate (NiTiO3) powders synthesized by sol–gel and solid state reaction. In: Materials Science in Semiconductor Processing. 37, 2015, S. 171, doi:10.1016/j.mssp.2015.02.063.
- M.S. Sadjadi, K. Zare, S. Khanahmadzadeh, M. Enhessari: Structural characterization of NiTiO3 nanopowders prepared by stearic acid gel method. In: Materials Letters. 62, 2008, S. 3679, doi:10.1016/j.matlet.2008.04.028.
- Guo‐Wei Zhou, Young Soo Kang: Synthesis and Characterization of the Nickel Titanate NiTiO3 Nanoparticles in CTAB Micelle. In: Journal of Dispersion Science and Technology. 27, 2006, S. 727, doi:10.1080/01932690600660376.
- Jian-Lei Wang, Yuan-Qing Li, Young-Ji Byon, Shi-Gang Mei, Guang-Lei Zhang: Synthesis and characterization of NiTiO3 yellow nano pigment with high solar radiation reflection efficiency. In: Powder Technology. Band 235, 1. Februar 2013, S. 303–306, doi:10.1016/j.powtec.2012.10.044 (sciencedirect.com).
- Fernando Pacheco-Torgal, João Labrincha, Luisa Cabeza, Claes Goeran Granqvist: Eco-efficient Materials for Mitigating Building Cooling Needs Design, Properties and Applications. Woodhead Publishing, 2015, ISBN 978-1-78242-401-7, S. 29 (eingeschränkte Vorschau in der Google-Buchsuche).

