Natriumselenat
Natriumselenat ist eine anorganische chemische Verbindung des Natriums aus der Gruppe der Selenate.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
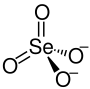 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Natriumselenat | |||||||||||||||
| Andere Namen |
Dinatriumtetraoxoselenat(IV) | |||||||||||||||
| Summenformel | Na2SeO4 | |||||||||||||||
| Kurzbeschreibung |
weißer geruchloser Feststoff[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 188,94 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Dichte |
3,213 g·cm−3 (17 °C)[1] | |||||||||||||||
| Löslichkeit |
585 g·l−1 bei 25 °C[2] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Gewinnung und Darstellung
Natriumselenat kann durch Reaktion einer Selensäure-Lösung mit Natriumcarbonat gewonnen werden.[3]
Eigenschaften
Natriumselenat ist ein nicht brennbarer, hygroskopischer, weißer, geruchloser Feststoff, der sehr leicht löslich in Wasser ist.[1] Es kristallisiert orthorhombisch, Raumgruppe Fddd (Raumgruppen-Nr. 70), mit den Gitterparametern a = 6,099 Å, b = 12,59 Å, c = 10,16 Å.[4]
Verwendung
Natriumselenat wird als Insektizid und als Zusatz von Düngemitteln verwendet.[1][5] Es wird in geringer Dosis auch als Nahrungsergänzungsmittel und in der Medizin verwendet.[6][7][8]
Einzelnachweise
- Eintrag zu Natriumselenat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2018. (JavaScript erforderlich)
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Physical Constants of Inorganic Compounds, S. 4-91.
- Georg Brauer (Hrsg.), unter Mitarbeit von Marianne Baudler u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band I, Ferdinand Enke, Stuttgart 1975, ISBN 3-432-02328-6, S. 425.
- A. Kalman, D.W.J. Cruickshank: A note on the structure of Na2SeO4. In: Acta Crystallographica, B26, 1970, S. 436, doi:10.1107/S0567740870002534.
- Ralf Steudel: Chemie der Nichtmetalle: Von Struktur und Bindung zur Anwendung. Walter de Gruyter, 2008, ISBN 3-11-021128-9, S. 468 (eingeschränkte Vorschau in der Google-Buchsuche).
- Klaus Karl Degitz, Hanns-Jürgen Krauß: Pathogenese, Klinik und Pharmakotherapie der Akne. Govi-Verlag Eschborn, 2004, ISBN 3-7741-1021-2 (eingeschränkte Vorschau in der Google-Buchsuche).
- Frank Wappler, Gerald Spilker: Verbrennungsmedizin: Vom Unfallort bis zur Rehabilitation. Georg Thieme Verlag, 2008, ISBN 3-13-159531-0, S. 78 (eingeschränkte Vorschau in der Google-Buchsuche).
- Irmgard Niestroj: Praxis der Orthomolekularen Medizin: Physiologische Grundlagen. Therapie mit ... Georg Thieme Verlag, 2000, ISBN 3-7773-1470-6, S. 480 (eingeschränkte Vorschau in der Google-Buchsuche).


