Native chemical ligation
Native chemical ligation (engl., dt. ‚native chemische Ligation‘) ist eine biochemische Methode der Proteinligation durch Verknüpfung von zwei oder mehreren Peptiden.
Eigenschaften
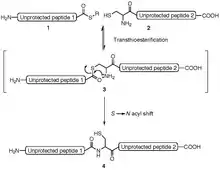
Durch die Proteinligation können zwei Peptide aneinander gekoppelt werden. Das N-terminale Peptid muss für die Proteinligation als letzte Aminosäure (an seinem C-Terminus) ein Thioester und das C-terminale Peptid muss für die Proteinligation als erste Aminosäure (an seinem N-Terminus) ein Cystein aufweisen. Im Zuge der Ligation bildet sich am Cystein eine Thioester-Bindung, die sich umestert und anschließend zur Peptidbindung umlagert (Thiotransesterifikation und S,N-acyl shift). Die Reaktion erfolgt in wässriger Lösung in Anwesenheit des Chaotrops Guanidiniumchlorid oder Harnstoff.[1] Als Thioester kann jede Aminosäure verwendet werden, jedoch sind Valin, Isoleucin und Prolin sterisch gehindert, wodurch die Reaktion langsamer verläuft.[2] Der C-terminale Thioester des N-terminalen Peptids wird meistens per Peptidsynthese mit Boc-Schutzgruppen erzeugt. Da Thioester-enthaltende Peptide nicht mit Fmoc-Schutzgruppen und nukleophilen Basen erzeugt werden können, wird mit Fmoc-Schutzgruppen ein Kenner safety catch linker zur Erzeugung der Thioester verwendet. Als Katalysator der Reaktion wird unter anderem Thiophenyl, 4-Mercaptophenylessigsäure (MPAA) oder 2-Mercaptoethansulfonat (MESNa) verwendet.
Alternative Verfahren zur Proteinligation wurden beschrieben, z. B. der Prior Thiol Capture, die Expressed Protein Ligation,[3] das Acyl-Initiated Capture und die Peptidligation mit Selenocystein.[4]
Geschichte
Die zugrundeliegende Reaktion der native chemical ligation wurde 1953 von Theodor Wieland veröffentlicht.[5] Ab 1994 wurde die Reaktion zur Erzeugung von Proteinen aus Peptiden durch S. B. Kent weiterentwickelt.[6][7]
Einzelnachweise
- T. W. Muir, P. E. Dawson, S. B. Kent: Protein synthesis by chemical ligation of unprotected peptides in aqueous solution. In: Methods in enzymology. Band 289, 1997, ISSN 0076-6879, S. 266–298, PMID 9353726.
- T. M. Hackeng, J. H. Griffin, P. E. Dawson: Protein synthesis by native chemical ligation: expanded scope by using straightforward methodology. In: Proceedings of the National Academy of Sciences. Band 96, Nummer 18, August 1999, ISSN 0027-8424, S. 10068–10073, PMID 10468563, PMC 17843 (freier Volltext).
- T. W. Muir, D. Sondhi, P. A. Cole: Expressed protein ligation: a general method for protein engineering. In: Proceedings of the National Academy of Sciences. Band 95, Nummer 12, Juni 1998, ISSN 0027-8424, S. 6705–6710, PMID 9618476, PMC 22605 (freier Volltext).
- B. L. Nilsson, M. B. Soellner, R. T. Raines: Chemical synthesis of proteins. In: Annual review of biophysics and biomolecular structure. Band 34, 2005, ISSN 1056-8700, S. 91–118, doi:10.1146/annurev.biophys.34.040204.144700, PMID 15869385, PMC 2845543 (freier Volltext).
- T. Wieland, E. Bokelmann, L. Bauer, H. U. Lang, H. Lau, W. Schafer: Polypeptide syntheses. VIII. Formation of sulfur containing peptides by the intramolecular migration of aminoacyl groups. In: Liebigs Ann Chem. Band 583, 1953, S. 129–149.
- P. E. Dawson, T. W. Muir, I. Clark-Lewis, S. B. Kent: Synthesis of proteins by native chemical ligation. In: Science. Band 266, Nummer 5186, November 1994, ISSN 0036-8075, S. 776–779. PMID 7973629.
- S. Kent: Total chemical synthesis of enzymes. In: Journal of peptide science : an official publication of the European Peptide Society. Band 9, Nummer 9, September 2003, ISSN 1075-2617, S. 574–593, doi:10.1002/psc.475. PMID 14552420.