GPCR-Oligomer
Ein GPCR-Oligomer ist ein als Oligomer bezeichneter Verband oder Komplex aus mehreren G-Protein-gekoppelten Rezeptoren, die unmittelbar Kontakt zueinander haben und durch Atombindungen bzw. zwischenmolekulare Kräfte zusammengehalten werden. Rezeptoren innerhalb des Verbandes heißen Protomere, während unverbundene Rezeptoren als Monomere bezeichnet werden. Rezeptor-Homomere[2] sind aus gleichen, Heteromere aus ungleichen Protomeren zusammengesetzt. Rezeptorenverbände, welche als solche, nicht aber in Gestalt ihrer Stammmonomere, nativ zur Reizübertragung fähig sind, werden als konstitutive Rezeptoren bezeichnet. Rezeptoren, die nur mittelbar miteinander in Verbindung stehen, werden nicht als Oligomere bezeichnet. Die funktionelle Wirkung einer Ligandbindung, die von einem Protomer auf ein oder mehrere andere Protomere übertragen wird, heißt Übersprechen. Die spezifische Art des funktionellen Zusammenwirkens von Liganden, die sich durch die Bindung an zwei oder mehr Protomere eines Komplexes ergibt, drückt sich als Kooperativität aus.[3]
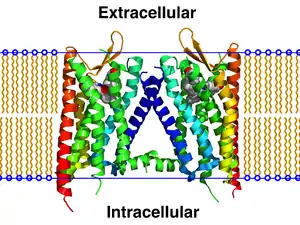
Die Existenz von Rezeptor-Oligomeren ist eine allgemeine Erscheinung, welche die lange Zeit vorherrschende paradigmatische Vorstellung von der Funktion von Rezeptoren als reine Monomere aufgehoben hat und deren Entdeckung weitreichende Folgen für das Verständnis von neurobiologischen Krankheiten sowie für die Entwicklung von Arzneistoffen hat.[4][5] Rezeptor-Oligomere und ihre Funktion im Interaktom werden ihrer Bedeutung entsprechend intensiv beforscht.
Die Oligomerisierung ist nicht beschränkt auf G-Protein-gekoppelte Rezeptoren, sondern wird auch an anderen Zielproteinen beobachtet, wie z. B. plasmalemmalen Transportern[6][7] und Ionenkanälen. Eine gruppenübergreifende funktionelle Interaktion ist möglich.[8]
Entdeckungsgeschichte
Lange Zeit ging man davon aus, Rezeptoren übermittelten Wirkungen ausschließlich in ihren funktionellen Grundformen – als Monomere. Der erste Hinweis auf die Existenz von GPCR-Oligomeren geht zurück auf das Jahr 1975. Lefkowitz und Mitarbeiter hatten an beta-Adrenozeptoren ein Verhalten beobachtet, das als negative Kooperativität bekannt ist und das auf der Existenz von Rezeptordimeren oder -oligomeren beruht.[9] Zu Beginn der 1980er Jahre wurde die Hypothese aufgestellt, Rezeptoren könnten größere Verbände, sogenannte Mosaike, ausbilden[10] oder zwei Rezeptoren könnten direkt miteinander interagieren.[11] Massenbestimmungen von beta-Adrenozeptoren (1982)[12] und Muskarinrezeptoren (1983) zeigten, dass die Rezeptoren in homodimeren oder -tetrameren Formen vorkommen können.[13] 1991 wurden Erscheinungen beobachtet, die als Übersprechen interpretiert werden können und somit auf eine Rezeptor-Heteromer-Expression hinwiesen. Gegenstand der Untersuchung waren Adenosin A2A- und Dopamin D2-Rezeptoren.[14] Maggio und Mitarbeiter zeigten 1993 die Fähigkeit zweier G-Protein-gekoppelter Rezeptoren zu heteromerisieren, indem sie Chimären von Muskarin-M3-Rezeptoren und α2C-Adrenozeptoren einsetzten.[15]
Im Jahr 2005 wurde der Beweis erbracht, dass Rezeptoroligomeren im lebenden Organismus funktionelle Bedeutung zukommt.[16] Die Kristallstruktur eines CXCR4-Dimers wurde im Jahr 2010 veröffentlicht.[17]
Eigenschaften der Oligomere
Auswirkung der Oligomerisierung
GPCR-Oligomere bestehen aus Dimeren, Trimeren, Tetrameren oder Verbänden höher Ordnung. Die Oligomere sind als Entitäten anzusehen, die Eigenschaften aufweisen, die sich mehr oder weniger und in vielerlei Hinsicht von denen der Monomeren unterscheiden. Der funktionelle Charakter eines Rezeptors ist abhängig von seiner tertiär- bzw. quartärstrukturellen Gestalt. Berühren sich Rezeptoren auf einer größeren Fläche oder an sensiblen Stellen, dann wirken Kräfte ein, die die Gestalt wie auch die innere Beweglichkeit der nunmehrigen Protomere verändern; kurzum, Protomere wirken als allosterische Modulatoren aufeinander ein. Dies hat Konsequenzen für:
- die Belieferung der Zelloberfläche mit Rezeptoren
- die Ligandbindung an diversen Bindungsstellen
- die G-Protein-Kopplung
- den innerzelluären Verkehr (vergleiche Signaltransduktion)
- die Modifizierung der Desensibilisierungsprofile
- die Neigung zur Endozytose und Internalisierung
- das postendozytotische Schicksal der Rezeptoren
Es ist gegenwärtig unklar, ob alle Rezeptoroligomere eine funktionelle Bedeutung in der Signalübertragung haben.
Siehe auch
Literatur
- R. Rozenfeld, L. A. Devi: Exploring a role for heteromerization in GPCR signalling specificity. In: Biochem J. Band 433, 2011, S. 11. PMID 21158738.
- N. J. Smith, G. Milligan: Allostery at G protein-coupled receptor homo- and heteromers: uncharted pharmacological landscapes. In: Pharmacological reviews. Band 62, Nummer 4, Dezember 2010, S. 701–725, doi:10.1124/pr.110.002667. PMID 21079041, PMC 2993260 (freier Volltext) (Review).
- J. González-Maeso: GPCR oligomers in pharmacology and signaling. In: Molecular brain. Band 4, Nummer 1, 2011, S. 20, doi:10.1186/1756-6606-4-20. PMID 21619615, PMC 3128055 (freier Volltext) (Review).
- J. Giraldo, J. P. Pin: G Protein-coupled Receptors: From Structure to Function. Royal Society of Chemistry, 2011, ISBN 978-1-84973-183-6.
- A. Gilchrist: GPCR Molecular Pharmacology and Drug Targeting: Shifting Paradigms and New Directions. John Wiley & Sons, 2010, ISBN 978-1-118-03517-7.
Einzelnachweise und Anmerkungen
- H. Wu u. a.: Structure of the human κ-opioid receptor in complex with JDTic. In: Nature. 2012. Epub. PMID 22437504.
- In Quasi-Homomeren sind einzelne Protomere modifiziert, die Modifikation wirkt sich aber nicht funktionell aus.
- Smith und Milligan (2010) beschreiben Kooperativität als die Wirkungen, die mehrfache Äquivalente ein und desselben Liganden haben, der an mehrere, im Allgemeinen identische Bindungsstellen bindet.
- L. Albizu, J. L. Moreno, J. González-Maeso, S. C. Sealfon: Heteromerization of G protein-coupled receptors: relevance to neurological disorders and neurotherapeutics. In: CNS Neurol Disord – Drug Targets. 2010, S. 636. PMID 20632964.
- R. Rozenfeld, L. A. Devi: Receptor heteromerization and drug discovery. In: Trends Pharmacol Sci. 2010, S. 124. PMID 20060175, PMC 2834828 (freier Volltext)
- J. A. Schmid u. a.: Oligomerization of the human serotonin transporter and of the rat GABA transporter 1 visualized by fluorescence resonance energy transfer microscopy in living cells. In: J Biol Chem. 2001, S. 3805. PMID 11071889.
- T. Sorkina, S. Doolen, E. Galperin, N. R. Zahniser, A. Sorkin: Oligomerization of dopamine transporters visualized in living cells by fluorescence resonance energy transfer microscopy. In: J Biol Chem. 2003, S. 28274. PMID 12746456.
- M. Wang u. a.: Schizophrenia, amphetamine-induced sensitized state and acute amphetamine exposure all show a common alteration: increased dopamine D2 receptor dimerization. In: Mol Brain. 2010, S. 25, Abschnitt "Discussion". PMID 20813060.
- L. E. Limbird, P. D. Meyts, R. J. Lefkowitz: Beta-adrenergic receptors: evidence for negative cooperativity. In: Biochem Biophys Res Commun. 1975, S. 1160. PMID 1137592.
- K. Fuxe u. a.: GPCR heteromers and their allosteric receptor-receptor interactions. In: Curr Med Chem. 2012, S. 356. PMID 22335512.
- N. J. Birdsall: Can different receptors interact directly with each other? In: Trends Neurosci. 1982, S. 137. ScienceDirect.
- C. M. Fraser, J. C. Venter: The size of the mammalian lung beta 2-adrenergic receptor as determined by target size analysis and immunoaffinity chromatography. In: Biochem Biophys Res Commun. 1982, S. 21. PMID 6297476.
- S. Avissar, G. Amitai, M. Sokolovsky: Oligomeric structure of muscarinic receptors is shown by photoaffinity labeling: subunit assembly may explain high- and low-affinity agonist states. In: PNAS. 1983, S. 156. PMID 6571990.
- S. Ferre, G. von Euler, B. Johansson, B. B. Fredholm, K. Fuxe: Stimulation of high-affinity adenosine A2 receptors decreases the affinity of dopamine D2 receptors in rat striatal membranes. In: PNAS. 1991, S. 7238. PMID 1678519, PMC 52269 (freier Volltext).
- R. Maggio, Z. Vogel, J. Wess: Coexpression studies with mutant muscarinic/adrenergic receptors provide evidence for intermolecular "cross-talk" between G-protein-linked receptors. In: PNAS. 1993, S. 3103. PMID 8385357, PMC 46245 (freier Volltext).
- M. Waldhoer u. a.: A heterodimer-selective agonist shows in vivo relevance of G protein-coupled receptor dimers. In: PNAS. 2005, S. 9050. PMID 15932946, PMC 1157030 (freier Volltext).
- B. Wu u. a.: Structures of the CXCR4 Chemokine GPCR with Small-Molecule and Cyclic Peptide Antagonists. In: Science. 2010, S. 1066. PMID 20929726.