Maytansinoide
Maytansinoide ist der Name einer Gruppe von Naturstoffen mit hoher zytotoxischer Wirkung. Die Maytansinoide wurden erstmals 1972 aus dem in Äthiopien beheimateten Strauch Maytenus serrata isoliert.
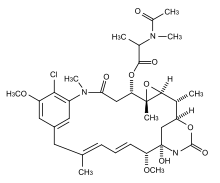
Beschreibung
Maytansinoide sind 19-gliedrige Lactame, die eine strukturelle Ähnlichkeit mit Rifamycinen, Geldanamycin und Ansatrienin (Mycotrienin) aufweisen. Da diese verwandten Verbindungen im Gegensatz zu den Maytansinoiden von Mikroorganismen gebildet werden, entstand schon früh der Verdacht, dass die Maytansinoide ebenfalls von Mikroorganismen gebildet werden. Mit dem Bakterium Actinosynnema pretiosum wurde auch ein Organismus gefunden, der in der Lage ist Maytansinoide zu produzieren. In der Folge wurden verschiedene Pflanzen entdeckt, die Maytansinoide enthalten, wie beispielsweise Colubrina texensis und Trewia nudiflora (Gutelbaum). Die pflanzliche Produktion ist dabei entweder durch einen horizontalen Gentransfer oder eine pflanzlich-mikrobielle Wechselwirkung bedingt.[1] Die Konzentration von Maytansin in getrocknetem Maytenus serrata beträgt lediglich etwa 2×10−5 Prozent. Die Verbindung ist gegen KB-Zellen (maligne humane Epithelzellen) hochtoxisch. Das ED50 (effektive Dosis) liegt zwischen 10−4 und 10−5 µg/ml.[2]
Es wurden im Laufe der Zeit eine Reihe von natürlichen Maytansinoid-Derivaten isoliert.[2] Sie unterscheiden sich vor allem in der Ester-Seitenkette (in der C-3-Position), in der sich unter anderem Fettsäuren oder auch L-Alanin befinden können. Auch N-demethylierte, deepoxidierte und C-10-Epimere wurden isoliert und charakterisiert.[1]
Maytansin, das dieser Familie von Verbindungen den Namen gab, wurde erstmals 1972 von S. Morris Kupchan und Kollegen des National Cancer Institute aus Maytenus serrata isoliert[3] und kurze Zeit später die Struktur mittels Röntgenstrukturanalyse aufgeklärt.[4]
Therapeutische Bedeutung
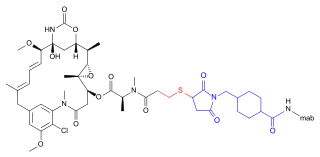
Das stark zytotoxische biogene Maytansin scheiterte als Antikrebsmittel in klinischen Studien aufgrund einer nicht akzeptablen systemischen Toxizität. Jedoch kann die Zytotoxizität in Verbindung mit einem Konzept der gezielten Abgabe zur selektiven Zerstörung von Krebszellen genutzt werden.[5] Das zytostatische Maytansin-Derivat DM1 etwa kann durch Konjugation an den monoklonalen Antikörper Trastuzumab zielgerichtet Tumorzellen zugeführt werden, wo es an die Mikrotubuli bindet und die Apoptose auslöst. Der Organismus ist nicht so hohen Dosen an hochtoxischem freien DM1 ausgesetzt, so dass systemische Nebenwirkungen reduziert werden können. Zugelassen ist das Antikörper-Wirkstoff-Konjugat T-DM1 (Trastuzumab-Emtansin) zur Behandlung von HER2/neu-positivem Brustkrebs.[6]
Literatur
- T. Boettcher: Kitasatospora putterlickiae F18-98, ein neu isolierter Bakterienstamm aus der Rhizosphäre von Putterlickia verrucosa - Molekularbiologische und biochemische Untersuchungen zur Aminohydroxybenzoesäure-Biosynthese. Dissertation, Universität Bonn, 2008. urn:nbn:de:hbz:5n-02912
- M. Hesse: Alkaloide. Helvetica Chimica Acta, Wiley-VCH, 2000, ISBN 3-906390-19-5, S. 216–217.
Weblinks
- Biosynthesis of Maytansinoids (englisch)
Einzelnachweise
- T. Frenzel: Studien zur chemoenzymatischen Synthese von Maytansinoid-Analoga : Synthese von seco-Proansamitocin. Dissertation, Universität Hannover, 2005.
- J. M. Cassady u. a.: Recent developments in the maytansinoid antitumor agents. In: Chem Pharm Bull 52, 2004, S. 1–26, PMID 14709862.
- S. M. Kupchan u. a.: Maytansine, a novel antileukemic ansa macrolide from Maytenus ovatus. In: J Am Chem Soc 94, 1972, S. 1354–136, PMID 5062169.
- S. M. Kupchan u. a.: The maytansinoids. Isolation, structural elucidation, and chemical interrelation of novel ansa macrolides. In: J Org Chem 42, 1977, S. 2349–2357, PMID 874612.
- W. C. Widdison u. a.: Semisynthetic maytansine analogues for the targeted treatment of cancer. In: J Med Chem 49, 2006, S. 4392–4408, PMID 16821799.
- I. Krop, E. P. Winer: Trastuzumab Emtansine: A Novel Antibody-Drug Conjugate for HER2-Positive Breast Cancer. In: Clinical Cancer Research. 20, 2014, S. 15, doi:10.1158/1078-0432.CCR-13-0541.