Magnesiumchromat
Magnesiumchromat ist ein Salz aus Magnesium und der Chromsäure. Es sind das Pentahydrat, Heptahydrat und das Undecahydrat bekannt.
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
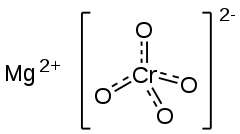 | |||||||||||||
| Allgemeines | |||||||||||||
| Name | Magnesiumchromat | ||||||||||||
| Andere Namen |
Magnesium(II)-Chrom(VI)-oxid | ||||||||||||
| Summenformel | Mg[CrO4] | ||||||||||||
| Kurzbeschreibung | |||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse |
| ||||||||||||
| Aggregatzustand |
fest | ||||||||||||
| Dichte |
4,18 g·cm−3[2] | ||||||||||||
| Schmelzpunkt |
1200–1250 °C (Zersetzung)[1] | ||||||||||||
| Löslichkeit |
leicht in Wasser (600 g·l−1 bei 18 °C)[3] | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||
Gewinnung und Darstellung
Das Magnesiumchromat-Heptahydrat kann aus einer Lösung aus Mg(OH)2 und Chromsäure hergestellt werden.[6]
Das Heptahydrat kann bei 335 °C zum Anhydrat zersetzt werden.[6]
Das Anhydrat kann durch Reaktion von Chrom(III)-oxid mit Magnesiumoxid und Sauerstoff bei hohem Druck gewonnen werden.[1]
Eigenschaften
Die Zersetzung von Magnesiumchromat-Heptahydrat läuft in vier Stufen ab.[6]
1. Stufe im Bereich 33–58 °C
2. Stufe im Bereich 127–150 °C
3. Stufe im Bereich 196–215 °C
4. Stufe bei 335 °C
Das wasserfreie Magnesiumchromat zersetzt sich bei über 600 °C.[6] Magnesiumchromat kommt in zwei Modifikationen vor der α- und der β-Modifikation.[7] Die α-Modifikation kristallisiert orthorhombisch in der Cr[VO4]-Struktur (Gitterparameter: a = 549,7, b = 836,8, c = 614,7 pm) und die β-Modifikation in der Co[MoO4]-Struktur (Gitterparameter: a = 995, b = 916, c = 675,9 pm und β = 103,68°).[7] Ein gelbes Magnesiumchromat-Undecahydrat (Mg[CrO4]∙11H2O) ist ebenfalls bekannt und kristallisiert isotyp zu Meridianiit (Mg[SO4]∙11H2O), triklin in der Raumgruppe P1 (Raumgruppen-Nr. 2) mit den Gitterkonstanten a = 677,21(18), b = 691,7(2), c = 1741,0(5) pm, α = 88,21(2)°, β = 89,43(2)° und γ = 62,768(18)° mit zwei Formeleinheiten pro Elementarzelle.[8][9]
Verwendung
Magnesiumchromat entsteht beim Chromatieren von Magnesiumlegierungen und dient dort als Korrosionsschutz.[10]
Sicherheit
Magnesiumchromat ist als krebserzeugend eingestuft.[5]
Einzelnachweise
- Jane E. Macintyre: Dictionary of Inorganic Compounds. CRC Press, 1992, ISBN 0-412-30120-2, S. 3076 (eingeschränkte Vorschau in der Google-Buchsuche).
- V. N.Titov: The metastable phase magnesium chromate (Mg2Cr2O5). In: Izvestiya Akademii Nauk SSSR, Neorganicheskie Materialy. Band V24, Nr. 11, 1988, S. 1934–1935.
- A. E. Hill, G. C. Soth, J. E. Ricci: The Systems Magnesium Chromate—Water and Ammonium Chromate—Water from 0 to 75°. In: J. Am. Chem. Soc. Band 62, Nr. 8, 1940, S. 2131–2134, doi:10.1021/ja01865a059.
- Nicht explizit in Verordnung (EG) Nr. 1272/2008 (CLP) gelistet, fällt aber mit der angegebenen Kennzeichnung unter den Gruppeneintrag Chrom(VI)-Verbindungen, mit Ausnahme von Bariumchromat und Verbindungen die in diesem Anhang gesondert aufgeführt sind im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 13. Mai 2020. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Eintrag zu Magnesiumchromat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 13. Mai 2020. (JavaScript erforderlich)
- Tadashi Nisino, Mogi Konasayoshi, Hiroshi Kano: Thermische Zersetzung von Magnesiumchromat. In: Journal of the Ceramic Association. Band 71, Nr. 812, 1963, S. 159–163, doi:10.2109/jcersj1950.71.812_159.
- O. Müller, W. B. White, R. Roy: X-ray diffraction study of the chromates of nickel, magnesium and cadmium. In: Zeitschrift für Kristallographie – Crystalline Materials. Band 130, 1969, S. 112–120, doi:10.1524/zkri.1969.130.16.112.
- A. D. Fortes, I. G. Wood, J. G. Matthias: MgSO4∙11H2O and MgCrO4∙11H2O based on time-of-flight neutron single-crystal Laue data. In: Acta Crystallographica. C69, 2013, S. 324–329, doi:10.1107/S0108270113005751.
- A. D. Fortes, I. G. Wood: X-ray powder diffraction analysis of a new magnesium chromate hydrate, MgCrO4∙11(H2O). In: Powder Diffraction. Band 27, Nr. 1, 2012, S. 8–11, doi:10.1017/S088571561200005X.
- Hubert Gräfen, VDI-Gesellschaft Werkstofftechnik: Lexikon Werkstofftechnik Berichtigter Nachdruck. Springer-Verlag, 2013, ISBN 978-3-642-51732-7, S. 130 (eingeschränkte Vorschau in der Google-Buchsuche).


